当前位置:
X-MOL 学术
›
Biomaterials
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
功能性纳米颗粒利用胆汁酸途径克服了肠道上皮的多种屏障,从而可以口服胰岛素
Biomaterials ( IF 12.8 ) Pub Date : 2017-10-13 , DOI: 10.1016/j.biomaterials.2017.10.022 Weiwei Fan , Dengning Xia , Quanlei Zhu , Xiuying Li , Shufang He , Chunliu Zhu , Shiyan Guo , Lars Hovgaard , Mingshi Yang , Yong Gan
Biomaterials ( IF 12.8 ) Pub Date : 2017-10-13 , DOI: 10.1016/j.biomaterials.2017.10.022 Weiwei Fan , Dengning Xia , Quanlei Zhu , Xiuying Li , Shufang He , Chunliu Zhu , Shiyan Guo , Lars Hovgaard , Mingshi Yang , Yong Gan
|
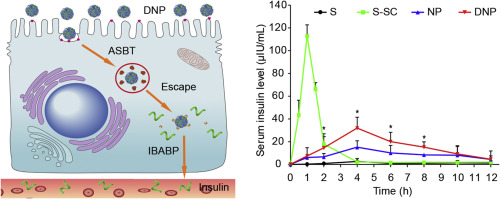
蛋白质/多肽负载的纳米颗粒的口服吸收通常受肠上皮的多个屏障的限制。除粘液易位和顶端内吞作用外,纳米粒子的高效经上皮吸收还需要成功的细胞内运输,尤其是避免溶酶体降解和基底外侧释放。在此,合成功能材料脱氧胆酸共轭壳聚糖,并将其与模型蛋白药物胰岛素一起加载到脱氧胆酸修饰的纳米颗粒(DNP)中。这项研究中设计的DNP被证明可通过利用胆汁酸途径克服肠道上皮的多种障碍。在Caco-2细胞单层中,DNP通过心钠依赖性胆汁酸转运蛋白(ASBT)介导的内吞作用而被内在化。有趣的是,由于DNP的溶酶体逸出,可显着防止上皮中的胰岛素降解。此外,DNP可以与胞浆回肠胆汁酸结合蛋白相互作用,从而促进胰岛素的细胞内运输和基底外侧释放。在大鼠中,活体双光子显微镜检查还显示DNP进入肠绒毛的转运是由ASBT介导的。进一步的药代动力学研究表明,将冻干的DNPs装入肠溶衣胶囊后,I型糖尿病大鼠的口服生物利用度为15.9%。因此,脱氧胆酸改性的壳聚糖纳米颗粒可以克服肠道上皮的多种口服给药胰岛素的障碍。DNP可与胞质回肠胆汁酸结合蛋白相互作用,从而促进胰岛素的细胞内运输和基底外侧释放。在大鼠中,活体双光子显微镜检查还显示DNP进入肠绒毛的转运是由ASBT介导的。进一步的药代动力学研究表明,将冻干的DNPs装入肠溶衣胶囊后,I型糖尿病大鼠的口服生物利用度为15.9%。因此,脱氧胆酸改性的壳聚糖纳米颗粒可以克服肠道上皮的多种口服给药胰岛素的障碍。DNP可与胞质回肠胆汁酸结合蛋白相互作用,从而促进胰岛素的细胞内运输和基底外侧释放。在大鼠中,活体双光子显微镜检查还显示DNP进入肠绒毛的转运是由ASBT介导的。进一步的药代动力学研究表明,将冻干的DNPs装入肠溶衣胶囊后,I型糖尿病大鼠的口服生物利用度为15.9%。因此,脱氧胆酸改性的壳聚糖纳米颗粒可以克服肠道上皮的多种口服给药胰岛素的障碍。进一步的药代动力学研究表明,将冻干的DNPs装入肠溶衣胶囊后,I型糖尿病大鼠的口服生物利用度为15.9%。因此,脱氧胆酸改性的壳聚糖纳米颗粒可以克服肠道上皮的多种口服给药胰岛素的障碍。进一步的药代动力学研究表明,将冻干的DNPs装入肠溶衣胶囊后,I型糖尿病大鼠的口服生物利用度为15.9%。因此,脱氧胆酸改性的壳聚糖纳米颗粒可以克服肠道上皮的多种口服给药胰岛素的障碍。

"点击查看英文标题和摘要"
更新日期:2017-10-13

"点击查看英文标题和摘要"































 京公网安备 11010802027423号
京公网安备 11010802027423号