当前位置:
X-MOL 学术
›
Nat. Commun.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Heparan sulfate proteoglycans present PCSK9 to the LDL receptor.
Nature Communications ( IF 14.7 ) Pub Date : 2017-09-11 , DOI: 10.1038/s41467-017-00568-7
Camilla Gustafsen , Ditte Olsen , Joachim Vilstrup , Signe Lund , Anika Reinhardt , Niels Wellner , Torben Larsen , Christian B. F. Andersen , Kathrin Weyer , Jin-ping Li , Peter H. Seeberger , Søren Thirup , Peder Madsen , Simon Glerup
Nature Communications ( IF 14.7 ) Pub Date : 2017-09-11 , DOI: 10.1038/s41467-017-00568-7
Camilla Gustafsen , Ditte Olsen , Joachim Vilstrup , Signe Lund , Anika Reinhardt , Niels Wellner , Torben Larsen , Christian B. F. Andersen , Kathrin Weyer , Jin-ping Li , Peter H. Seeberger , Søren Thirup , Peder Madsen , Simon Glerup
|
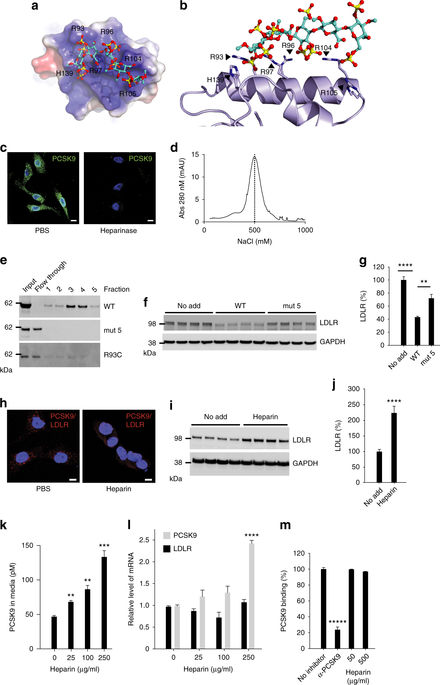
Coronary artery disease is the main cause of death worldwide and accelerated by increased plasma levels of cholesterol-rich low-density lipoprotein particles (LDL). Circulating PCSK9 contributes to coronary artery disease by inducing lysosomal degradation of the LDL receptor (LDLR) in the liver and thereby reducing LDL clearance. Here, we show that liver heparan sulfate proteoglycans are PCSK9 receptors and essential for PCSK9-induced LDLR degradation. The heparan sulfate-binding site is located in the PCSK9 prodomain and formed by surface-exposed basic residues interacting with trisulfated heparan sulfate disaccharide repeats. Accordingly, heparan sulfate mimetics and monoclonal antibodies directed against the heparan sulfate-binding site are potent PCSK9 inhibitors. We propose that heparan sulfate proteoglycans lining the hepatocyte surface capture PCSK9 and facilitates subsequent PCSK9:LDLR complex formation. Our findings provide new insights into LDL biology and show that targeting PCSK9 using heparan sulfate mimetics is a potential therapeutic strategy in coronary artery disease.PCSK9 interacts with LDL receptor, causing its degradation, and consequently reduces the clearance of LDL. Here, Gustafsen et al. show that PCSK9 interacts with heparan sulfate proteoglycans and this binding favors LDLR degradation. Pharmacological inhibition of this binding can be exploited as therapeutic intervention to lower LDL levels.
中文翻译:

硫酸乙酰肝素蛋白聚糖将PCSK9呈递给LDL受体。
冠状动脉疾病是全球范围内的主要死亡原因,血浆中富含胆固醇的低密度脂蛋白颗粒(LDL)含量升高会加速这种疾病的发生。循环中的PCSK9通过诱导肝脏中LDL受体(LDLR)的溶酶体降解,从而降低LDL清除率而导致冠状动脉疾病。在这里,我们表明,肝素硫酸肝素蛋白聚糖是PCSK9受体,对于PCSK9诱导的LDLR降解至关重要。硫酸乙酰肝素结合位点位于PCSK9前结构域中,由表面暴露的碱性残基与三硫酸化硫酸乙酰肝素二糖重复序列相互作用形成。因此,硫酸乙酰肝素模拟物和针对硫酸乙酰肝素结合位点的单克隆抗体是有效的PCSK9抑制剂。我们建议衬在肝细胞表面的硫酸乙酰肝素蛋白聚糖捕获PCSK9,并促进后续PCSK9:LDLR复合物的形成。我们的发现为LDL生物学提供了新的见解,并表明使用硫酸乙酰肝素模拟物靶向PCSK9是冠状动脉疾病的潜在治疗策略.PCSK9与LDL受体相互作用,导致其降解并因此降低了LDL的清除率。在这里,古斯塔夫森(Gustafsen)等人。结果表明PCSK9与硫酸乙酰肝素蛋白聚糖相互作用,这种结合有利于LDLR降解。对该结合的药理学抑制作用可被用作降低LDL水平的治疗干预。我们的发现为LDL生物学提供了新的见解,并表明使用硫酸乙酰肝素模拟物靶向PCSK9是冠状动脉疾病的潜在治疗策略.PCSK9与LDL受体相互作用,导致其降解并因此降低了LDL的清除率。在这里,古斯塔夫森(Gustafsen)等人。结果表明PCSK9与硫酸乙酰肝素蛋白聚糖相互作用,这种结合有利于LDLR降解。对该结合的药理学抑制作用可被用作降低LDL水平的治疗干预。我们的发现为LDL生物学提供了新的见解,并表明使用硫酸乙酰肝素模拟物靶向PCSK9是冠状动脉疾病的潜在治疗策略.PCSK9与LDL受体相互作用,导致其降解并因此降低了LDL的清除率。在这里,古斯塔夫森(Gustafsen)等人。结果表明PCSK9与硫酸乙酰肝素蛋白聚糖相互作用,这种结合有利于LDLR降解。对该结合的药理学抑制作用可被用作降低LDL水平的治疗干预。
更新日期:2017-09-11
中文翻译:

硫酸乙酰肝素蛋白聚糖将PCSK9呈递给LDL受体。
冠状动脉疾病是全球范围内的主要死亡原因,血浆中富含胆固醇的低密度脂蛋白颗粒(LDL)含量升高会加速这种疾病的发生。循环中的PCSK9通过诱导肝脏中LDL受体(LDLR)的溶酶体降解,从而降低LDL清除率而导致冠状动脉疾病。在这里,我们表明,肝素硫酸肝素蛋白聚糖是PCSK9受体,对于PCSK9诱导的LDLR降解至关重要。硫酸乙酰肝素结合位点位于PCSK9前结构域中,由表面暴露的碱性残基与三硫酸化硫酸乙酰肝素二糖重复序列相互作用形成。因此,硫酸乙酰肝素模拟物和针对硫酸乙酰肝素结合位点的单克隆抗体是有效的PCSK9抑制剂。我们建议衬在肝细胞表面的硫酸乙酰肝素蛋白聚糖捕获PCSK9,并促进后续PCSK9:LDLR复合物的形成。我们的发现为LDL生物学提供了新的见解,并表明使用硫酸乙酰肝素模拟物靶向PCSK9是冠状动脉疾病的潜在治疗策略.PCSK9与LDL受体相互作用,导致其降解并因此降低了LDL的清除率。在这里,古斯塔夫森(Gustafsen)等人。结果表明PCSK9与硫酸乙酰肝素蛋白聚糖相互作用,这种结合有利于LDLR降解。对该结合的药理学抑制作用可被用作降低LDL水平的治疗干预。我们的发现为LDL生物学提供了新的见解,并表明使用硫酸乙酰肝素模拟物靶向PCSK9是冠状动脉疾病的潜在治疗策略.PCSK9与LDL受体相互作用,导致其降解并因此降低了LDL的清除率。在这里,古斯塔夫森(Gustafsen)等人。结果表明PCSK9与硫酸乙酰肝素蛋白聚糖相互作用,这种结合有利于LDLR降解。对该结合的药理学抑制作用可被用作降低LDL水平的治疗干预。我们的发现为LDL生物学提供了新的见解,并表明使用硫酸乙酰肝素模拟物靶向PCSK9是冠状动脉疾病的潜在治疗策略.PCSK9与LDL受体相互作用,导致其降解并因此降低了LDL的清除率。在这里,古斯塔夫森(Gustafsen)等人。结果表明PCSK9与硫酸乙酰肝素蛋白聚糖相互作用,这种结合有利于LDLR降解。对该结合的药理学抑制作用可被用作降低LDL水平的治疗干预。

































 京公网安备 11010802027423号
京公网安备 11010802027423号