当前位置:
X-MOL 学术
›
Nat. Commun.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
TAK1介导的磷酸化对RIPK1活化的调控决定了细胞凋亡和坏死性坏死。
Nature Communications ( IF 14.7 ) Pub Date : 2017-08-25 , DOI: 10.1038/s41467-017-00406-w
Jiefei Geng , Yasushi Ito , Linyu Shi , Palak Amin , Jiachen Chu , Amanda Tomie Ouchida , Adnan Kasim Mookhtiar , Heng Zhao , Daichao Xu , Bing Shan , Ayaz Najafov , Guangping Gao , Shizuo Akira , Junying Yuan
Nature Communications ( IF 14.7 ) Pub Date : 2017-08-25 , DOI: 10.1038/s41467-017-00406-w
Jiefei Geng , Yasushi Ito , Linyu Shi , Palak Amin , Jiachen Chu , Amanda Tomie Ouchida , Adnan Kasim Mookhtiar , Heng Zhao , Daichao Xu , Bing Shan , Ayaz Najafov , Guangping Gao , Shizuo Akira , Junying Yuan
|
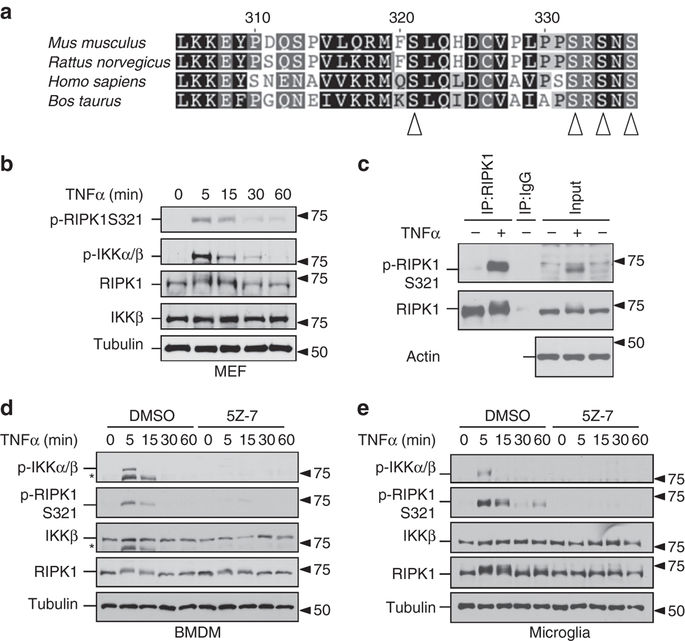
TNFα刺激TNFR1可以促进细胞死亡的三种不同的替代机制:坏死病,独立于RIPK1和依赖于细胞凋亡。细胞如何决定死亡的方式尚不清楚。在这里,我们报告说,TAK1介导的TNFα诱导的RIPK1在中间结构域的磷酸化在调节这一关键决定中起着关键作用。使用磷酸化Ser321作为标记,我们表明当环己酰亚胺抑制NF-κB活化时,TNFα诱导的RIPK1中间结构域的瞬时磷酸化导致RIPK1依赖性凋亡。另一方面,阻断Ser321磷酸化可促进RIPK1活化及其与FADD的相互作用,以介导RIPK1依赖性细胞凋亡(RDA)。最后,TAK1在多个位点对RIPK1中间结构域的持续磷酸化促进了其与RIPK3的相互作用和坏死性坏死。因此,TAK1介导的RIPK1磷酸化的缺乏,瞬时和持续水平可能代表TNF-RSC中的不同状态,以指示三种另类细胞死亡机制的激活:RDA,独立于RIPK1的细胞凋亡和坏死性坏死.TNFα可以促进三种不同的细胞死亡机制:坏死性坏死,RIPK1依赖性和依赖性凋亡。在这里,作者表明,由TAK1介导的TNFα诱导的RIPK1在中间结构域的磷酸化在调节这一决定中起着关键作用。

"点击查看英文标题和摘要"
更新日期:2017-08-25

"点击查看英文标题和摘要"

































 京公网安备 11010802027423号
京公网安备 11010802027423号