Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
糖基转移酶BgsA中的新型c-di-GMP结合结构域负责混合连接的β-葡聚糖的合成。
Scientific Reports ( IF 3.8 ) Pub Date : 2017-Aug-21 , DOI: 10.1038/s41598-017-09290-2
Daniel Pérez-Mendoza , Daniela Bertinetti , Robin Lorenz , María-Trinidad Gallegos , Friedrich W. Herberg , Juan Sanjuán
Scientific Reports ( IF 3.8 ) Pub Date : 2017-Aug-21 , DOI: 10.1038/s41598-017-09290-2
Daniel Pérez-Mendoza , Daniela Bertinetti , Robin Lorenz , María-Trinidad Gallegos , Friedrich W. Herberg , Juan Sanjuán
|
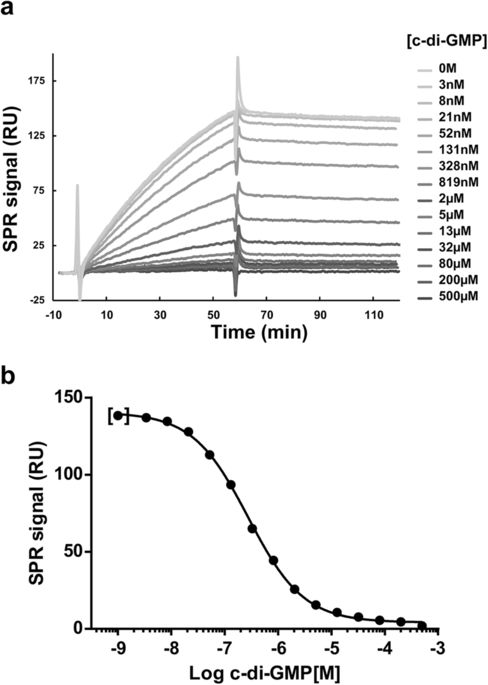
BgsA是一种糖基转移酶(GT),参与线性混合连接的β-葡聚糖(MLG)的合成,MLG是最近描述的由c-di-GMP激活的苜蓿中华根瘤菌和其他根瘤菌中的胞外多糖。尽管BgsA显示与细菌纤维素合酶(CS)的序列和结构同源性,但它不包含任何可预测的c-di-GMP结合域。在这项工作中,我们证明了BgsA的胞质C末端结构域(C-BgsA)以高亲和力(K D = 0.23μM)和特异性。C-BgsA在结构上与CS的其他等效胞质C末端结构域不同,并且不包含用于c-di-GMP识别的PilZ基序。将随机诱变和定点诱变与表面等离振子共振(SPR)结合使用,可以鉴定C-BgsA残基,这不仅对c-di-GMP结合很重要,而且对BgsA GT活性也很重要。结果表明,C-BgsA结构域对于c-di-GMP结合和BgsA的GT活性均很重要。与细菌CS(其中c-di-GMP被提议作为GT活性的阻遏物)相反,我们假设BgsA的C末端结构域在结合c-di-GMP后在BgsA GT活性中起积极作用。

"点击查看英文标题和摘要"
更新日期:2017-08-21

"点击查看英文标题和摘要"

































 京公网安备 11010802027423号
京公网安备 11010802027423号