当前位置:
X-MOL 学术
›
ACS Chem. Biol.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
工程细胞内保留的高斯荧光素酶报道基因,以改善生物传感和分子成像应用
ACS Chemical Biology ( IF 3.5 ) Pub Date : 2017-08-10 00:00:00 , DOI: 10.1021/acschembio.7b00454 Shuchi Gaur 1 , Aarohi Bhargava-Shah 1 , Sharon Hori 1 , Rayhaneh Afjei 1 , Thillai V. Sekar 1 , Sanjiv S. Gambhir 1 , Tarik F. Massoud 1 , Ramasamy Paulmurugan 1
ACS Chemical Biology ( IF 3.5 ) Pub Date : 2017-08-10 00:00:00 , DOI: 10.1021/acschembio.7b00454 Shuchi Gaur 1 , Aarohi Bhargava-Shah 1 , Sharon Hori 1 , Rayhaneh Afjei 1 , Thillai V. Sekar 1 , Sanjiv S. Gambhir 1 , Tarik F. Massoud 1 , Ramasamy Paulmurugan 1
Affiliation
|
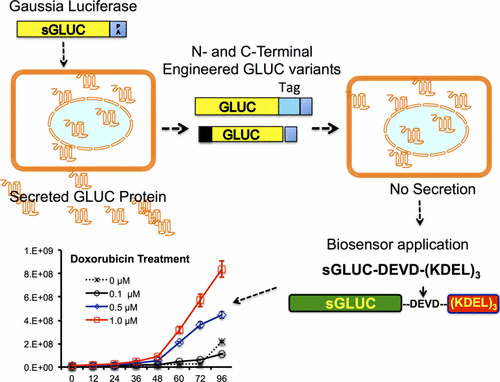
高斯荧光素酶(GLUC)是一种越来越重要的生物发光报告蛋白。作为一种分泌蛋白,它比其竞争对手分泌的碱性磷酸酶具有更高的体外和体内敏感性(分别为约20000倍和约1000倍)。不幸的是,GLUC的这种同样有利的分泌特性限制了它在许多其他可能的细胞内应用中的有用性,例如在体内完整细胞中的成像信号通路成像,以及开发分子成像生物传感器来研究蛋白质间相互作用和蛋白质折叠。因此,为了拓宽GLUC的研究应用范围,我们开发了经过工程改造的变体,既可以通过修饰N末端分泌信号肽,也可以通过将其他序列标记到其C末端区域来增加其细胞内保留。我们发现,当GLUC在哺乳动物细胞中表达时,它的N末端分泌信号肽(包含氨基酸1-16)除了具有固有的分泌特性外,对于GLUC折叠和功能活性也是必不可少的。通过在多个重复序列中标记四个氨基酸(KDEL)内质网靶向肽修饰GLUC的C端,可显着改善其细胞内滞留性,对其折叠和酶活性几乎没有影响。我们使用表达带有KDEL重复序列的工程化GLUC的稳定细胞来监测化学诱导的内质网对细胞的应激。此外,我们使用修饰的GLUC变异体设计了一种凋亡传感器,该变异体在GLUC蛋白和KDEL重复序列之间包含四个氨基酸的半胱天冬酶底物肽(DEVD)。当用化学治疗药物阿霉素,紫杉醇和卡铂处理细胞时,其在细胞培养中的使用导致生长培养基中GLUC分泌增加。因此,我们成功地设计了一种新的变体GLUC蛋白,该蛋白保留在细胞内而不是分泌到细胞外。我们通过将其纳入生物传感器来检测细胞内质网应激和caspase激活,从而验证了该新型报道基因。

"点击查看英文标题和摘要"
更新日期:2017-08-10

"点击查看英文标题和摘要"






























 京公网安备 11010802027423号
京公网安备 11010802027423号