当前位置:
X-MOL 学术
›
Nat. Commun.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
RORα controls hepatic lipid homeostasis via negative regulation of PPARγ transcriptional network.
Nature Communications ( IF 14.7 ) Pub Date : 2017-07-31 , DOI: 10.1038/s41467-017-00215-1 Kyeongkyu Kim , Kyungjin Boo , Young Suk Yu , Se Kyu Oh , Hyunkyung Kim , Yoon Jeon , Jinhyuk Bhin , Daehee Hwang , Keun Il Kim , Jun-Su Lee , Seung-Soon Im , Seul Gi Yoon , Il Yong Kim , Je Kyung Seong , Ho Lee , Sungsoon Fang , Sung Hee Baek
Nature Communications ( IF 14.7 ) Pub Date : 2017-07-31 , DOI: 10.1038/s41467-017-00215-1 Kyeongkyu Kim , Kyungjin Boo , Young Suk Yu , Se Kyu Oh , Hyunkyung Kim , Yoon Jeon , Jinhyuk Bhin , Daehee Hwang , Keun Il Kim , Jun-Su Lee , Seung-Soon Im , Seul Gi Yoon , Il Yong Kim , Je Kyung Seong , Ho Lee , Sungsoon Fang , Sung Hee Baek
|
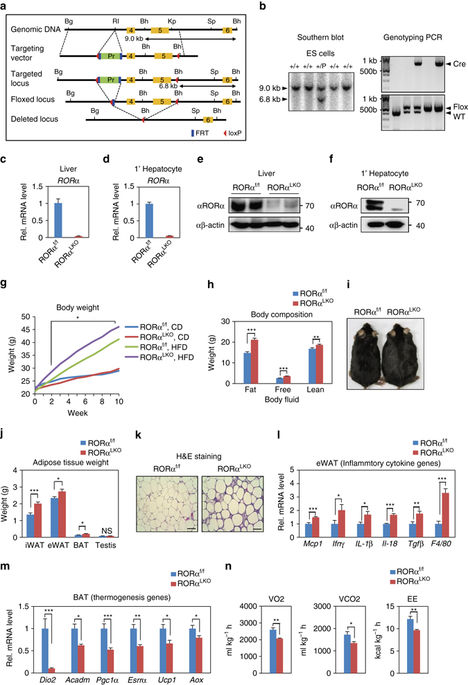
The retinoic acid receptor-related orphan receptor-α (RORα) is an important regulator of various biological processes, including cerebellum development, circadian rhythm and cancer. Here, we show that hepatic RORα controls lipid homeostasis by negatively regulating transcriptional activity of peroxisome proliferators-activated receptor-γ (PPARγ) that mediates hepatic lipid metabolism. Liver-specific Rorα-deficient mice develop hepatic steatosis, obesity and insulin resistance when challenged with a high-fat diet (HFD). Global transcriptome analysis reveals that liver-specific deletion of Rorα leads to the dysregulation of PPARγ signaling and increases hepatic glucose and lipid metabolism. RORα specifically binds and recruits histone deacetylase 3 (HDAC3) to PPARγ target promoters for the transcriptional repression of PPARγ. PPARγ antagonism restores metabolic homeostasis in HFD-fed liver-specific Rorα deficient mice. Our data indicate that RORα has a pivotal role in the regulation of hepatic lipid homeostasis. Therapeutic strategies designed to modulate RORα activity may be beneficial for the treatment of metabolic disorders.Hepatic steatosis development may result from dysregulation of lipid metabolism, which is finely tuned by several transcription factors including the PPAR family. Here Kim et al. show that the nuclear receptor RORα inhibits PPARγ-mediated transcriptional activity by interacting with HDAC3 and competing for the promoters of lipogenic genes.
中文翻译:

RORα通过PPARγ转录网络的负调控来控制肝脂质稳态。
视黄酸受体相关的孤儿受体-α(RORα)是各种生物学过程(包括小脑发育,昼夜节律和癌症)的重要调节剂。在这里,我们显示肝脏RORα通过负调节过氧化物酶体增殖物激活的受体-γ(PPARγ)介导肝脂质代谢的转录活性来控制脂质体内平衡。当受到高脂饮食(HFD)攻击时,肝脏特异性Rorα缺陷型小鼠会发展为肝脂肪变性,肥胖和胰岛素抵抗。全局转录组分析显示,肝脏特定的Rorα缺失导致PPARγ信号传导失调,并增加肝糖和脂质代谢。RORα特异性结合并募集组蛋白脱乙酰基酶3(HDAC3)到PPARγ靶标启动子上,以抑制PPARγ的转录。PPARγ拮抗作用可恢复由HFD喂养的肝脏特异性Rorα缺陷型小鼠的代谢稳态。我们的数据表明,RORα在调节肝脂质稳态方面具有关键作用。旨在调节RORα活性的治疗策略可能有益于代谢紊乱的治疗。脂类代谢失调可能导致肝脂肪变性的发展,脂质代谢失调可以通过包括PPAR家族在内的多种转录因子进行微调。在这里金等。证明核受体RORα通过与HDAC3相互作用并竞争生脂基因的启动子来抑制PPARγ介导的转录活性。旨在调节RORα活性的治疗策略可能有益于代谢紊乱的治疗。脂类代谢失调可能导致肝脂肪变性的发展,脂质代谢失调可以通过包括PPAR家族在内的多种转录因子进行微调。在这里金等。证明核受体RORα通过与HDAC3相互作用并竞争生脂基因的启动子来抑制PPARγ介导的转录活性。旨在调节RORα活性的治疗策略可能有益于代谢紊乱的治疗。脂类代谢失调可能导致肝脂肪变性的发展,脂质代谢失调可以通过包括PPAR家族在内的多种转录因子进行微调。在这里金等。证明核受体RORα通过与HDAC3相互作用并竞争生脂基因的启动子来抑制PPARγ介导的转录活性。
更新日期:2017-07-31
中文翻译:

RORα通过PPARγ转录网络的负调控来控制肝脂质稳态。
视黄酸受体相关的孤儿受体-α(RORα)是各种生物学过程(包括小脑发育,昼夜节律和癌症)的重要调节剂。在这里,我们显示肝脏RORα通过负调节过氧化物酶体增殖物激活的受体-γ(PPARγ)介导肝脂质代谢的转录活性来控制脂质体内平衡。当受到高脂饮食(HFD)攻击时,肝脏特异性Rorα缺陷型小鼠会发展为肝脂肪变性,肥胖和胰岛素抵抗。全局转录组分析显示,肝脏特定的Rorα缺失导致PPARγ信号传导失调,并增加肝糖和脂质代谢。RORα特异性结合并募集组蛋白脱乙酰基酶3(HDAC3)到PPARγ靶标启动子上,以抑制PPARγ的转录。PPARγ拮抗作用可恢复由HFD喂养的肝脏特异性Rorα缺陷型小鼠的代谢稳态。我们的数据表明,RORα在调节肝脂质稳态方面具有关键作用。旨在调节RORα活性的治疗策略可能有益于代谢紊乱的治疗。脂类代谢失调可能导致肝脂肪变性的发展,脂质代谢失调可以通过包括PPAR家族在内的多种转录因子进行微调。在这里金等。证明核受体RORα通过与HDAC3相互作用并竞争生脂基因的启动子来抑制PPARγ介导的转录活性。旨在调节RORα活性的治疗策略可能有益于代谢紊乱的治疗。脂类代谢失调可能导致肝脂肪变性的发展,脂质代谢失调可以通过包括PPAR家族在内的多种转录因子进行微调。在这里金等。证明核受体RORα通过与HDAC3相互作用并竞争生脂基因的启动子来抑制PPARγ介导的转录活性。旨在调节RORα活性的治疗策略可能有益于代谢紊乱的治疗。脂类代谢失调可能导致肝脂肪变性的发展,脂质代谢失调可以通过包括PPAR家族在内的多种转录因子进行微调。在这里金等。证明核受体RORα通过与HDAC3相互作用并竞争生脂基因的启动子来抑制PPARγ介导的转录活性。































 京公网安备 11010802027423号
京公网安备 11010802027423号