当前位置:
X-MOL 学术
›
J. Proteome Res.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Global Phosphoproteomic Analysis of Insulin/Akt/mTORC1/S6K Signaling in Rat Hepatocytes
Journal of Proteome Research ( IF 3.8 ) Pub Date : 2017-07-19 00:00:00 , DOI: 10.1021/acs.jproteome.7b00140 Yuanyuan Zhang 1 , Yajie Zhang 2 , Yonghao Yu 2
Journal of Proteome Research ( IF 3.8 ) Pub Date : 2017-07-19 00:00:00 , DOI: 10.1021/acs.jproteome.7b00140 Yuanyuan Zhang 1 , Yajie Zhang 2 , Yonghao Yu 2
Affiliation
|
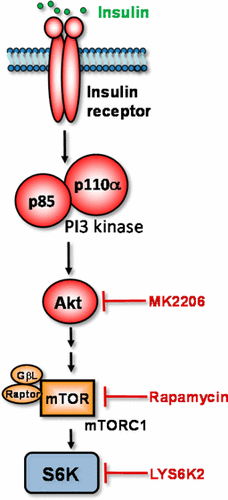
Insulin resistance is a hallmark of type 2 diabetes. Although multiple genetic and physiological factors interact to cause insulin resistance, deregulated signaling by phosphorylation is a common underlying mechanism. In particular, the specific phosphorylation-dependent regulatory mechanisms and signaling outputs of insulin are poorly understood in hepatocytes, which represents one of the most important insulin-responsive cell types. Using primary rat hepatocytes as a model system, we performed reductive dimethylation (ReDi)-based quantitative mass spectrometric analysis and characterized the phosphoproteome that is regulated by insulin as well as its key downstream kinases including Akt, mTORC1, and S6K. We identified a total of 12 294 unique, confidently localized phosphorylation sites and 3805 phosphorylated proteins in this single cell type. Detailed bioinformatic analysis on each individual data set identified both known and previously unrecognized targets of this key insulin downstream effector pathway. Furthermore, integrated analysis of the hepatic Akt/mTORC1/S6K signaling axis allowed the delineation of the substrate specificity of several close-related kinases within the insulin signaling pathway. We expect that the data sets will serve as an invaluable resource, providing the foundation for future hypothesis-driven research that helps delineate the molecular mechanisms that underlie the pathogenesis of type 2 diabetes and related metabolic syndrome.
中文翻译:

大鼠肝细胞中胰岛素/ Akt / mTORC1 / S6K信号的全球磷酸化蛋白质组学分析
胰岛素抵抗是2型糖尿病的标志。尽管多种遗传和生理因素相互作用导致胰岛素抵抗,但磷酸化引起的信号转导失调是一种常见的潜在机制。特别地,在肝细胞中对胰岛素的特定磷酸化依赖性调节机制和信号输出的了解很少,肝细胞代表最重要的胰岛素反应性细胞类型之一。使用原代大鼠肝细胞作为模型系统,我们进行了基于还原二甲基化(ReDi)的定量质谱分析,并表征了受胰岛素及其主要下游激酶(包括Akt,mTORC1和S6K)调节的磷酸化蛋白质组。我们在这种单细胞类型中总共鉴定了12 294个独特的,自信地定位的磷酸化位点和3805个磷酸化的蛋白。对每个单独的数据集进行详细的生物信息学分析,可以确定该关键胰岛素下游效应子途径的已知和先前无法识别的靶标。此外,肝Akt / mTORC1 / S6K信号转导轴的综合分析可以描述胰岛素信号转导途径中几种紧密相关激酶的底物特异性。我们希望这些数据集将成为不可估量的资源,为未来的假设驱动研究提供基础,这有助于描述构成2型糖尿病和相关代谢综合征发病机制的分子机制。肝Akt / mTORC1 / S6K信号转导轴的综合分析可以描述胰岛素信号转导途径中几种紧密相关激酶的底物特异性。我们希望这些数据集将成为不可估量的资源,为未来的假设驱动研究提供基础,这有助于描述构成2型糖尿病和相关代谢综合征发病机制的分子机制。肝Akt / mTORC1 / S6K信号转导轴的综合分析可以描述胰岛素信号转导途径中几种紧密相关激酶的底物特异性。我们希望这些数据集将成为不可估量的资源,为未来的假设驱动研究提供基础,这有助于描述构成2型糖尿病和相关代谢综合征发病机制的分子机制。
更新日期:2017-07-20
中文翻译:

大鼠肝细胞中胰岛素/ Akt / mTORC1 / S6K信号的全球磷酸化蛋白质组学分析
胰岛素抵抗是2型糖尿病的标志。尽管多种遗传和生理因素相互作用导致胰岛素抵抗,但磷酸化引起的信号转导失调是一种常见的潜在机制。特别地,在肝细胞中对胰岛素的特定磷酸化依赖性调节机制和信号输出的了解很少,肝细胞代表最重要的胰岛素反应性细胞类型之一。使用原代大鼠肝细胞作为模型系统,我们进行了基于还原二甲基化(ReDi)的定量质谱分析,并表征了受胰岛素及其主要下游激酶(包括Akt,mTORC1和S6K)调节的磷酸化蛋白质组。我们在这种单细胞类型中总共鉴定了12 294个独特的,自信地定位的磷酸化位点和3805个磷酸化的蛋白。对每个单独的数据集进行详细的生物信息学分析,可以确定该关键胰岛素下游效应子途径的已知和先前无法识别的靶标。此外,肝Akt / mTORC1 / S6K信号转导轴的综合分析可以描述胰岛素信号转导途径中几种紧密相关激酶的底物特异性。我们希望这些数据集将成为不可估量的资源,为未来的假设驱动研究提供基础,这有助于描述构成2型糖尿病和相关代谢综合征发病机制的分子机制。肝Akt / mTORC1 / S6K信号转导轴的综合分析可以描述胰岛素信号转导途径中几种紧密相关激酶的底物特异性。我们希望这些数据集将成为不可估量的资源,为未来的假设驱动研究提供基础,这有助于描述构成2型糖尿病和相关代谢综合征发病机制的分子机制。肝Akt / mTORC1 / S6K信号转导轴的综合分析可以描述胰岛素信号转导途径中几种紧密相关激酶的底物特异性。我们希望这些数据集将成为不可估量的资源,为未来的假设驱动研究提供基础,这有助于描述构成2型糖尿病和相关代谢综合征发病机制的分子机制。





















































 京公网安备 11010802027423号
京公网安备 11010802027423号