当前位置:
X-MOL 学术
›
ACS Biomater. Sci. Eng.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
原弹性蛋白结构和组装的靶向调节
ACS Biomaterials Science & Engineering ( IF 5.4 ) Pub Date : 2016-11-21 00:00:00 , DOI: 10.1021/acsbiomaterials.6b00564 Giselle C Yeo 1, 1, 1 , Clair Baldock 2 , Steven G Wise 1, 3 , Anthony S Weiss 1, 1, 1
Affiliation
|
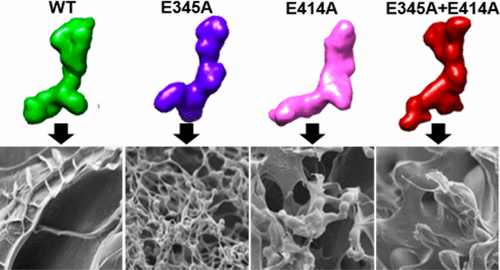
原弹性蛋白作为弹性蛋白的单体单元,组装成弹性纤维,赋予弹性组织强度和弹性。原弹性蛋白还广泛用于制造具有特定机械和生物特性的多功能材料。原弹性蛋白组装成弹性纤维或生物材料受到关键亚分子区域和这些域内的特定残基的至关重要的影响。在这项工作中,我们确定了两个很少出现的带负电残基(结构域 19 中的谷氨酸 345 和结构域 21 中的谷氨酸 414)在共同维持弹性蛋白原铰链、桥和足区域的天然构象中的功能贡献。 E345 和/或 E414 的丙氨酸取代会不同程度地改变这些区域的定位和交互可及性,如纳米结构研究所示以及抗体和细胞探针检测到的。这些结构变化与单体凝聚、交联成形态和功能非典型水凝胶的倾向较低以及弹性纤维形成明显受损和异常相关。我们的工作表明 E345 和 E414 残基在调节人原弹性蛋白的特定局部结构和高阶组装中具有至关重要的意义。

"点击查看英文标题和摘要"































 京公网安备 11010802027423号
京公网安备 11010802027423号