当前位置:
X-MOL 学术
›
Food Hydrocoll.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
牛免疫球蛋白G的热变性及其与其他乳清蛋白的关系
Food Hydrocolloids ( IF 11.0 ) Pub Date :
Dimuthu Bogahawaththa, Jayani Chandrapala, Todor Vasiljevic
Food Hydrocolloids ( IF 11.0 ) Pub Date :
Dimuthu Bogahawaththa, Jayani Chandrapala, Todor Vasiljevic
|
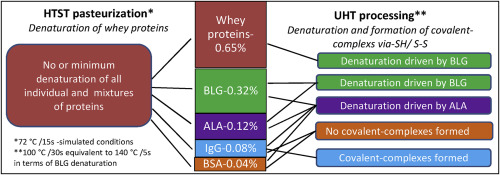
单独研究牛免疫球蛋白G(IgG)的热变性并在主要乳清蛋白存在下进行了研究。与高温短时(HTST,72°C / 15s)和超高温(UHT,100°C / 30s相当于140°C / 5s)相比,研究的两种加热方式提供了模拟的热效应。 β-乳球蛋白的变性)条件。当它们单独或以乳清蛋白混合物形式存在时,模拟的HTST条件对IgG和其他乳清蛋白的二级结构的影响最小。在100°C下加热30秒会导致IgG单独以及在混合物中形成IgG共价复合物,主要是通过巯基-二硫键反应。在100°C / 30s处理下,牛血清白蛋白(BSA)在蛋白质(IgG和BSA)的二元混合物中不通过硫醇-二硫键反应与IgG相互作用。在蛋白质混合物(BLG,ALA,IgG和BSA)中,α-乳清蛋白(ALA)似乎比β-乳球蛋白(BLG)优先导致乳清蛋白变性,表明BSA和/或IgG对ALA可能具有催化作用,而天然乳清则含有另一种可以抑制这种作用的成分。其他乳清蛋白的存在对100°C时IgG的热稳定性没有帮助。

"点击查看英文标题和摘要"
更新日期:2017-06-24

"点击查看英文标题和摘要"

































 京公网安备 11010802027423号
京公网安备 11010802027423号