当前位置:
X-MOL 学术
›
Anal. Chem.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Single-Molecule Detection of Polynucleotide Kinase Based on Phosphorylation-Directed Recovery of Fluorescence Quenched by Au Nanoparticles
Analytical Chemistry ( IF 6.7 ) Pub Date : 2017-06-16 00:00:00 , DOI: 10.1021/acs.analchem.7b01783 Li-juan Wang 1 , Qianyi Zhang 2 , Bo Tang 1 , Chun-yang Zhang 1
Analytical Chemistry ( IF 6.7 ) Pub Date : 2017-06-16 00:00:00 , DOI: 10.1021/acs.analchem.7b01783 Li-juan Wang 1 , Qianyi Zhang 2 , Bo Tang 1 , Chun-yang Zhang 1
Affiliation
|
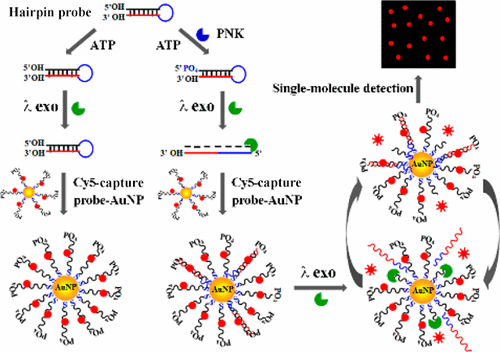
5′-Polynucleotide kinase such as T4 polynucleotide kinase (T4 PNK) may catalyze the phosphorylation of 5′-hydroxyl termini in nucleic acids, playing a crucial role in DNA replication, DNA recombination, and DNA damage repair. Here, we demonstrate for the first time single-molecule detection of PNK based on phosphorylation-directed recovery of fluorescence quenched by Au nanoparticle (AuNP) in combination with lambda exonuclease-mediated cleavage reaction. In the presence of PNK, the γ-phosphate group from adenosine triphosphate (ATP) is transferred to 5′-hydroxyl terminus, resulting in 5′-phosphorylation of the hairpin probe. The phosphorylated hairpin probes may function as the substrates of lambda exonuclease and enable the removal of 5′ mononucleotides from the stem, leading to the unfolding of hairpin structure and the formation of binding probes. The resultant binding probes may specifically hybridize with the AuNP-modified capture probes, forming double-strand DNA (dsDNA) duplexes with 5′-phosphate groups as the substrates of lambda exonuclease and subsequently leading to the cleavage of capture probes and the liberation of Cy5 molecules and the binding probes. The released binding probes may further hybridize with new capture probes, inducing cycles of digestion-release-hybridization and consequently the release of numerous Cy5 molecules. Through simply monitoring Cy5 molecules with total internal reflection fluorescence (TIRF)-based imaging, PNK activity can be quantitatively measured. This assay is very sensitive with a limit of detection of 9.77 × 10–8 U/μL, and it may be further used to screen the PNK inhibitors and measure PNK in cancer cell extracts.
中文翻译:

基于磷酸化的金纳米粒子猝灭荧光定向恢复的多核苷酸激酶单分子检测
5'-多核苷酸激酶,例如T4多核苷酸激酶(T4 PNK)可以催化核酸中5'-羟基末端的磷酸化,在DNA复制,DNA重组和DNA损伤修复中起关键作用。在这里,我们首次证明了结合金纳米颗粒核酸外切酶介导的裂解反应,通过金纳米颗粒(AuNP)淬灭的荧光的磷酸化定向回收,首次证明了PNK的单分子检测。在存在PNK的情况下,来自三磷酸腺苷(ATP)的γ-磷酸基团被转移到5'-羟基末端,导致发夹探针的5'-磷酸化。磷酸化的发夹探针可以充当λ核酸外切酶的底物,并能够从茎中去除5'单核苷酸,导致发夹结构的展开和结合探针的形成。所得的结合探针可以与AuNP修饰的捕获探针特异性杂交,形成具有5'-磷酸基团的双链DNA(dsDNA)双链体,作为λ核酸外切酶的底物,随后导致捕获探针的裂解和Cy5的释放分子和结合探针。释放的结合探针可进一步与新的捕获探针杂交,诱导消化-释放-杂交的循环,并因此释放大量Cy5分子。通过使用基于全内反射荧光(TIRF)的成像简单地监测Cy5分子,可以定量测量PNK活性。该测定非常敏感,检出限为9.77×10 所得的结合探针可以与AuNP修饰的捕获探针特异性杂交,形成具有5'-磷酸基团的双链DNA(dsDNA)双链体,作为λ核酸外切酶的底物,随后导致捕获探针的裂解和Cy5的释放分子和结合探针。释放的结合探针可进一步与新的捕获探针杂交,诱导消化-释放-杂交的循环,并因此释放大量Cy5分子。通过使用基于全内反射荧光(TIRF)的成像简单地监测Cy5分子,可以定量测量PNK活性。该测定非常敏感,检出限为9.77×10 所得的结合探针可以与AuNP修饰的捕获探针特异性杂交,形成具有5'-磷酸基团的双链DNA(dsDNA)双链体,作为λ核酸外切酶的底物,随后导致捕获探针的裂解和Cy5的释放分子和结合探针。释放的结合探针可进一步与新的捕获探针杂交,诱导消化-释放-杂交的循环,并因此释放大量Cy5分子。通过使用基于全内反射荧光(TIRF)的成像简单地监测Cy5分子,可以定量测量PNK活性。该测定非常敏感,检出限为9.77×10 形成具有5'-磷酸基团的双链DNA(dsDNA)双链体作为λ核酸外切酶的底物,随后导致捕获探针的裂解以及Cy5分子和结合探针的释放。释放的结合探针可进一步与新的捕获探针杂交,诱导消化-释放-杂交的循环,并因此释放大量Cy5分子。通过使用基于全内反射荧光(TIRF)的成像简单地监测Cy5分子,可以定量测量PNK活性。该测定非常敏感,检出限为9.77×10 形成具有5'-磷酸基团的双链DNA(dsDNA)双链体作为λ核酸外切酶的底物,随后导致捕获探针的裂解以及Cy5分子和结合探针的释放。释放的结合探针可进一步与新的捕获探针杂交,诱导消化-释放-杂交的循环,并因此释放大量Cy5分子。通过使用基于全内反射荧光(TIRF)的成像简单地监测Cy5分子,可以定量测量PNK活性。该测定非常敏感,检出限为9.77×10 诱导消化-释放-杂交的周期,并因此释放大量Cy5分子。通过使用基于全内反射荧光(TIRF)的成像简单地监测Cy5分子,可以定量测量PNK活性。该测定非常敏感,检出限为9.77×10 诱导消化-释放-杂交的周期,并因此释放大量Cy5分子。通过使用基于全内反射荧光(TIRF)的成像简单地监测Cy5分子,可以定量测量PNK活性。该测定非常敏感,检出限为9.77×10–8 U /μL,它还可用于筛选PNK抑制剂并测量癌细胞提取物中的PNK。
更新日期:2017-06-28
中文翻译:

基于磷酸化的金纳米粒子猝灭荧光定向恢复的多核苷酸激酶单分子检测
5'-多核苷酸激酶,例如T4多核苷酸激酶(T4 PNK)可以催化核酸中5'-羟基末端的磷酸化,在DNA复制,DNA重组和DNA损伤修复中起关键作用。在这里,我们首次证明了结合金纳米颗粒核酸外切酶介导的裂解反应,通过金纳米颗粒(AuNP)淬灭的荧光的磷酸化定向回收,首次证明了PNK的单分子检测。在存在PNK的情况下,来自三磷酸腺苷(ATP)的γ-磷酸基团被转移到5'-羟基末端,导致发夹探针的5'-磷酸化。磷酸化的发夹探针可以充当λ核酸外切酶的底物,并能够从茎中去除5'单核苷酸,导致发夹结构的展开和结合探针的形成。所得的结合探针可以与AuNP修饰的捕获探针特异性杂交,形成具有5'-磷酸基团的双链DNA(dsDNA)双链体,作为λ核酸外切酶的底物,随后导致捕获探针的裂解和Cy5的释放分子和结合探针。释放的结合探针可进一步与新的捕获探针杂交,诱导消化-释放-杂交的循环,并因此释放大量Cy5分子。通过使用基于全内反射荧光(TIRF)的成像简单地监测Cy5分子,可以定量测量PNK活性。该测定非常敏感,检出限为9.77×10 所得的结合探针可以与AuNP修饰的捕获探针特异性杂交,形成具有5'-磷酸基团的双链DNA(dsDNA)双链体,作为λ核酸外切酶的底物,随后导致捕获探针的裂解和Cy5的释放分子和结合探针。释放的结合探针可进一步与新的捕获探针杂交,诱导消化-释放-杂交的循环,并因此释放大量Cy5分子。通过使用基于全内反射荧光(TIRF)的成像简单地监测Cy5分子,可以定量测量PNK活性。该测定非常敏感,检出限为9.77×10 所得的结合探针可以与AuNP修饰的捕获探针特异性杂交,形成具有5'-磷酸基团的双链DNA(dsDNA)双链体,作为λ核酸外切酶的底物,随后导致捕获探针的裂解和Cy5的释放分子和结合探针。释放的结合探针可进一步与新的捕获探针杂交,诱导消化-释放-杂交的循环,并因此释放大量Cy5分子。通过使用基于全内反射荧光(TIRF)的成像简单地监测Cy5分子,可以定量测量PNK活性。该测定非常敏感,检出限为9.77×10 形成具有5'-磷酸基团的双链DNA(dsDNA)双链体作为λ核酸外切酶的底物,随后导致捕获探针的裂解以及Cy5分子和结合探针的释放。释放的结合探针可进一步与新的捕获探针杂交,诱导消化-释放-杂交的循环,并因此释放大量Cy5分子。通过使用基于全内反射荧光(TIRF)的成像简单地监测Cy5分子,可以定量测量PNK活性。该测定非常敏感,检出限为9.77×10 形成具有5'-磷酸基团的双链DNA(dsDNA)双链体作为λ核酸外切酶的底物,随后导致捕获探针的裂解以及Cy5分子和结合探针的释放。释放的结合探针可进一步与新的捕获探针杂交,诱导消化-释放-杂交的循环,并因此释放大量Cy5分子。通过使用基于全内反射荧光(TIRF)的成像简单地监测Cy5分子,可以定量测量PNK活性。该测定非常敏感,检出限为9.77×10 诱导消化-释放-杂交的周期,并因此释放大量Cy5分子。通过使用基于全内反射荧光(TIRF)的成像简单地监测Cy5分子,可以定量测量PNK活性。该测定非常敏感,检出限为9.77×10 诱导消化-释放-杂交的周期,并因此释放大量Cy5分子。通过使用基于全内反射荧光(TIRF)的成像简单地监测Cy5分子,可以定量测量PNK活性。该测定非常敏感,检出限为9.77×10–8 U /μL,它还可用于筛选PNK抑制剂并测量癌细胞提取物中的PNK。






























 京公网安备 11010802027423号
京公网安备 11010802027423号