当前位置:
X-MOL 学术
›
ACS Chem. Biol.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Comparison of the Deacylase and Deacetylase Activity of Zinc-Dependent HDACs
ACS Chemical Biology ( IF 3.5 ) Pub Date : 2017-05-01 00:00:00 , DOI: 10.1021/acschembio.7b00321
Jesse J. McClure 1 , Elizabeth S. Inks 1 , Cheng Zhang 2 , Yuri K. Peterson 1 , Jiaying Li 1 , Kalyan Chundru 1 , Bradley Lee 1, 3 , Ashley Buchanan 3 , Shiqin Miao 4 , C. James Chou 1
ACS Chemical Biology ( IF 3.5 ) Pub Date : 2017-05-01 00:00:00 , DOI: 10.1021/acschembio.7b00321
Jesse J. McClure 1 , Elizabeth S. Inks 1 , Cheng Zhang 2 , Yuri K. Peterson 1 , Jiaying Li 1 , Kalyan Chundru 1 , Bradley Lee 1, 3 , Ashley Buchanan 3 , Shiqin Miao 4 , C. James Chou 1
Affiliation
|
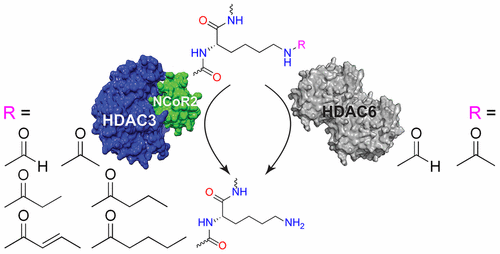
The acetylation status of lysine residues on histone proteins has long been attributed to a balance struck between the catalytic activity of histone acetyl transferases and histone deacetylases (HDAC). HDACs were identified as the sole removers of acetyl post-translational modifications (PTM) of histone lysine residues. Studies into the biological role of HDACs have also elucidated their role as removers of acetyl PTMs from lysine residues of nonhistone proteins. These findings, coupled with high-resolution mass spectrometry studies that revealed the presence of acyl-group PTMs on lysine residues of nonhistone proteins, brought forth the possibility of HDACs acting as removers of both acyl- and acetyl-based PTMs. We posited that HDACs fulfill this dual role and sought to investigate their specificity. Utilizing a fluorescence-based assay and biologically relevant acyl-substrates, the selectivities of zinc-dependent HDACs toward these acyl-based PTMs were identified. These findings were further validated using cellular models and molecular biology techniques. As a proof of principal, an HDAC3 selective inhibitor was designed using HDAC3’s substrate preference. This resulting inhibitor demonstrates nanomolar activity and >30 fold selectivity toward HDAC3 compared to the other class I HDACs. This inhibitor is capable of increasing p65 acetylation, attenuating NF-κB activation, and thereby preventing downstream nitric oxide signaling. Additionally, this selective HDAC3 inhibition allows for control of HMGB-1 secretion from activated macrophages without altering the acetylation status of histones or tubulin.
中文翻译:

锌依赖性HDAC的脱酰基酶和脱乙酰酶活性的比较
长久以来,组蛋白上赖氨酸残基的乙酰化状态一直归因于组蛋白乙酰转移酶和组蛋白脱乙酰酶(HDAC)的催化活性之间的平衡。HDAC被确定为组蛋白赖氨酸残基的乙酰化翻译后修饰(PTM)的唯一去除剂。对HDAC的生物学作用的研究也阐明了它们作为非组蛋白蛋白质赖氨酸残基上的乙酰基PTM去除剂的作用。这些发现与高分辨率质谱研究一起揭示了在非组蛋白蛋白质的赖氨酸残基上存在酰基PTM的可能性,提出了HDAC充当基于酰基和基于乙酰基的PTM去除剂的可能性。我们假设HDAC发挥了双重作用,并试图研究其特异性。利用基于荧光的分析方法和生物学相关的酰基底物,鉴定了锌依赖性HDAC对这些基于酰基的PTM的选择性。使用细胞模型和分子生物学技术进一步验证了这些发现。作为原理证明,使用HDAC3的底物偏好设计了HDAC3选择性抑制剂。与其他I类HDAC相比,该抑制剂表现出纳摩尔活性,对HDAC3的选择性> 30倍。该抑制剂能够增加p65的乙酰化,减弱NF-κB的活化,从而防止下游的一氧化氮信号传导。另外,这种选择性的HDAC3抑制作用可控制活化巨噬细胞分泌HMGB-1,而不会改变组蛋白或微管蛋白的乙酰化状态。鉴定了锌依赖性HDAC对这些基于酰基的PTM的选择性。使用细胞模型和分子生物学技术进一步验证了这些发现。作为原理证明,使用HDAC3的底物偏好设计了HDAC3选择性抑制剂。与其他I类HDAC相比,该抑制剂表现出纳摩尔活性,对HDAC3的选择性> 30倍。该抑制剂能够增加p65的乙酰化,减弱NF-κB的活化,从而防止下游的一氧化氮信号传导。另外,这种选择性的HDAC3抑制作用可控制活化巨噬细胞分泌HMGB-1,而不会改变组蛋白或微管蛋白的乙酰化状态。鉴定了锌依赖性HDAC对这些基于酰基的PTM的选择性。使用细胞模型和分子生物学技术进一步验证了这些发现。作为原理证明,使用HDAC3的底物偏好设计了HDAC3选择性抑制剂。与其他I类HDAC相比,该抑制剂表现出纳摩尔活性,对HDAC3的选择性> 30倍。该抑制剂能够增加p65的乙酰化,减弱NF-κB的活化,从而防止下游的一氧化氮信号传导。另外,这种选择性的HDAC3抑制作用可控制活化巨噬细胞分泌HMGB-1,而不会改变组蛋白或微管蛋白的乙酰化状态。使用细胞模型和分子生物学技术进一步验证了这些发现。作为原理证明,使用HDAC3的底物偏好设计了HDAC3选择性抑制剂。与其他I类HDAC相比,该抑制剂表现出纳摩尔活性,对HDAC3的选择性> 30倍。该抑制剂能够增加p65的乙酰化,减弱NF-κB的活化,从而防止下游的一氧化氮信号传导。另外,这种选择性的HDAC3抑制作用可控制活化巨噬细胞分泌HMGB-1,而不会改变组蛋白或微管蛋白的乙酰化状态。使用细胞模型和分子生物学技术进一步验证了这些发现。作为原理证明,使用HDAC3的底物偏好设计了HDAC3选择性抑制剂。与其他I类HDAC相比,该抑制剂表现出纳摩尔活性,对HDAC3的选择性> 30倍。该抑制剂能够增加p65的乙酰化,减弱NF-κB的活化,从而防止下游的一氧化氮信号传导。另外,这种选择性的HDAC3抑制作用可控制活化巨噬细胞分泌HMGB-1,而不会改变组蛋白或微管蛋白的乙酰化状态。与其他I类HDAC相比,该抑制剂表现出纳摩尔活性,对HDAC3的选择性> 30倍。该抑制剂能够增加p65的乙酰化,减弱NF-κB的活化,从而防止下游的一氧化氮信号传导。另外,这种选择性的HDAC3抑制作用可控制活化巨噬细胞分泌HMGB-1,而不会改变组蛋白或微管蛋白的乙酰化状态。与其他I类HDAC相比,该抑制剂表现出纳摩尔活性,对HDAC3的选择性> 30倍。该抑制剂能够增加p65的乙酰化,减弱NF-κB的活化,从而防止下游的一氧化氮信号传导。另外,这种选择性的HDAC3抑制作用可控制活化巨噬细胞分泌HMGB-1,而不会改变组蛋白或微管蛋白的乙酰化状态。
更新日期:2017-05-05
中文翻译:

锌依赖性HDAC的脱酰基酶和脱乙酰酶活性的比较
长久以来,组蛋白上赖氨酸残基的乙酰化状态一直归因于组蛋白乙酰转移酶和组蛋白脱乙酰酶(HDAC)的催化活性之间的平衡。HDAC被确定为组蛋白赖氨酸残基的乙酰化翻译后修饰(PTM)的唯一去除剂。对HDAC的生物学作用的研究也阐明了它们作为非组蛋白蛋白质赖氨酸残基上的乙酰基PTM去除剂的作用。这些发现与高分辨率质谱研究一起揭示了在非组蛋白蛋白质的赖氨酸残基上存在酰基PTM的可能性,提出了HDAC充当基于酰基和基于乙酰基的PTM去除剂的可能性。我们假设HDAC发挥了双重作用,并试图研究其特异性。利用基于荧光的分析方法和生物学相关的酰基底物,鉴定了锌依赖性HDAC对这些基于酰基的PTM的选择性。使用细胞模型和分子生物学技术进一步验证了这些发现。作为原理证明,使用HDAC3的底物偏好设计了HDAC3选择性抑制剂。与其他I类HDAC相比,该抑制剂表现出纳摩尔活性,对HDAC3的选择性> 30倍。该抑制剂能够增加p65的乙酰化,减弱NF-κB的活化,从而防止下游的一氧化氮信号传导。另外,这种选择性的HDAC3抑制作用可控制活化巨噬细胞分泌HMGB-1,而不会改变组蛋白或微管蛋白的乙酰化状态。鉴定了锌依赖性HDAC对这些基于酰基的PTM的选择性。使用细胞模型和分子生物学技术进一步验证了这些发现。作为原理证明,使用HDAC3的底物偏好设计了HDAC3选择性抑制剂。与其他I类HDAC相比,该抑制剂表现出纳摩尔活性,对HDAC3的选择性> 30倍。该抑制剂能够增加p65的乙酰化,减弱NF-κB的活化,从而防止下游的一氧化氮信号传导。另外,这种选择性的HDAC3抑制作用可控制活化巨噬细胞分泌HMGB-1,而不会改变组蛋白或微管蛋白的乙酰化状态。鉴定了锌依赖性HDAC对这些基于酰基的PTM的选择性。使用细胞模型和分子生物学技术进一步验证了这些发现。作为原理证明,使用HDAC3的底物偏好设计了HDAC3选择性抑制剂。与其他I类HDAC相比,该抑制剂表现出纳摩尔活性,对HDAC3的选择性> 30倍。该抑制剂能够增加p65的乙酰化,减弱NF-κB的活化,从而防止下游的一氧化氮信号传导。另外,这种选择性的HDAC3抑制作用可控制活化巨噬细胞分泌HMGB-1,而不会改变组蛋白或微管蛋白的乙酰化状态。使用细胞模型和分子生物学技术进一步验证了这些发现。作为原理证明,使用HDAC3的底物偏好设计了HDAC3选择性抑制剂。与其他I类HDAC相比,该抑制剂表现出纳摩尔活性,对HDAC3的选择性> 30倍。该抑制剂能够增加p65的乙酰化,减弱NF-κB的活化,从而防止下游的一氧化氮信号传导。另外,这种选择性的HDAC3抑制作用可控制活化巨噬细胞分泌HMGB-1,而不会改变组蛋白或微管蛋白的乙酰化状态。使用细胞模型和分子生物学技术进一步验证了这些发现。作为原理证明,使用HDAC3的底物偏好设计了HDAC3选择性抑制剂。与其他I类HDAC相比,该抑制剂表现出纳摩尔活性,对HDAC3的选择性> 30倍。该抑制剂能够增加p65的乙酰化,减弱NF-κB的活化,从而防止下游的一氧化氮信号传导。另外,这种选择性的HDAC3抑制作用可控制活化巨噬细胞分泌HMGB-1,而不会改变组蛋白或微管蛋白的乙酰化状态。与其他I类HDAC相比,该抑制剂表现出纳摩尔活性,对HDAC3的选择性> 30倍。该抑制剂能够增加p65的乙酰化,减弱NF-κB的活化,从而防止下游的一氧化氮信号传导。另外,这种选择性的HDAC3抑制作用可控制活化巨噬细胞分泌HMGB-1,而不会改变组蛋白或微管蛋白的乙酰化状态。与其他I类HDAC相比,该抑制剂表现出纳摩尔活性,对HDAC3的选择性> 30倍。该抑制剂能够增加p65的乙酰化,减弱NF-κB的活化,从而防止下游的一氧化氮信号传导。另外,这种选择性的HDAC3抑制作用可控制活化巨噬细胞分泌HMGB-1,而不会改变组蛋白或微管蛋白的乙酰化状态。

































 京公网安备 11010802027423号
京公网安备 11010802027423号