当前位置:
X-MOL 学术
›
J. Phys. Chem. Lett.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
霍夫迈斯特阴离子对模型蛋白界面张力的影响的分子水平洞察
The Journal of Physical Chemistry Letters ( IF 4.8 ) Pub Date : 2017-03-23 00:00:00 , DOI: 10.1021/acs.jpclett.7b00069
Soohaeng Yoo Willow 1 , Sotiris S. Xantheas 2
The Journal of Physical Chemistry Letters ( IF 4.8 ) Pub Date : 2017-03-23 00:00:00 , DOI: 10.1021/acs.jpclett.7b00069
Soohaeng Yoo Willow 1 , Sotiris S. Xantheas 2
Affiliation
|
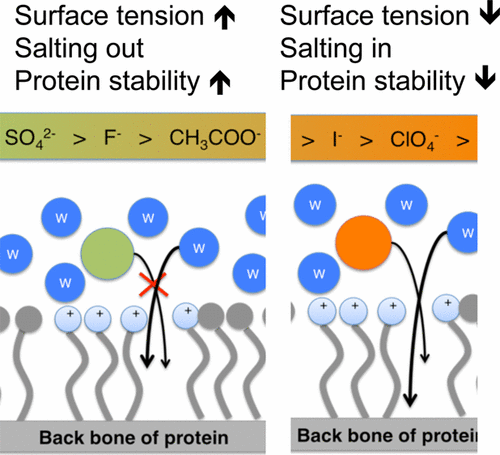
霍夫迈斯特阴离子对蛋白质沉淀的影响通常使用液-汽共存系统进行讨论,并假设液-汽界面模拟了液-蛋白质界面。然而,溶剂化的蛋白质在其表面上既有疏水区又有亲水区,而不仅仅是纯粹的疏水区。使用由疏水性和带正电荷的亲水性表面的溶剂化平行β片层中,我们调查的亲液(SO吸附4 2-)和离液剂(CLO 4 -)通过使用BLYP密度泛函理论的Born–Oppenheimer分子动力学模拟,对蛋白质的疏水性和亲水性表面的阴离子。已经发现两种阴离子都倾向于驻留在亲水性表面上。此外,诸如SO 4 2–的均质阴离子增强了蛋白质的界面表面张力并稳定了蛋白质,而相比之下,诸如ClO 4 –的离液阴离子则减弱了蛋白质的界面表面张力并允许水分子渗透到肽键形成水-肽氢键,从而破坏了蛋白质的稳定性。

"点击查看英文标题和摘要"
更新日期:2017-03-23

"点击查看英文标题和摘要"

































 京公网安备 11010802027423号
京公网安备 11010802027423号