当前位置:
X-MOL 学术
›
Nat. Chem. Biol.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
烯醇不对称酶促脱水的结构和功能见解
Nature Chemical Biology ( IF 12.9 ) Pub Date : 2017-01-09 , DOI: 10.1038/nchembio.2271 Bettina M Nestl , Christopher Geinitz , Stephanie Popa , Sari Rizek , Robert J Haselbeck , Rosary Stephen , Michael A Noble , Max-Philipp Fischer , Erik C Ralph , Hoi Ting Hau , Henry Man , Muhiadin Omar , Johan P Turkenburg , Stephen van Dien , Stephanie J Culler , Gideon Grogan , Bernhard Hauer

"点击查看英文标题和摘要"
更新日期:2017-01-11
Nature Chemical Biology ( IF 12.9 ) Pub Date : 2017-01-09 , DOI: 10.1038/nchembio.2271 Bettina M Nestl , Christopher Geinitz , Stephanie Popa , Sari Rizek , Robert J Haselbeck , Rosary Stephen , Michael A Noble , Max-Philipp Fischer , Erik C Ralph , Hoi Ting Hau , Henry Man , Muhiadin Omar , Johan P Turkenburg , Stephen van Dien , Stephanie J Culler , Gideon Grogan , Bernhard Hauer
|
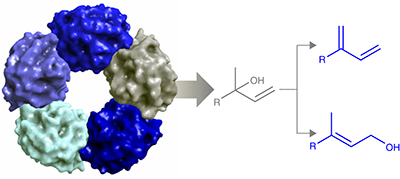
醇的不对称脱水是直接合成烯烃的重要过程。我们报告的结构和底物特异性的双功能芳樟醇脱水酶异构酶(LinD)从自然界中催化β-月桂烯水合到芳樟醇和随后的异构化成香叶醇的Castellaniella defragrans细菌。包含特定特征基序的截短和延长的芳香族和脂肪族叔醇(C5-C15)的酶促动力学拆分证明了LinD具有广泛的底物特异性。林德从三维结构Castellaniella defragrans揭示了一个五聚体,在前体界面处具有活性位点。此外,LinD与香叶醇产物复合的结构为这种双功能酶提供了初步的力学见解。定点诱变证实了其脱水和异构化活性必不可少的活性位点氨基酸残基。这些结构和机理的见解促进了水合催化剂的开发,丰富了用于新型键形成生物催化的工具箱。

"点击查看英文标题和摘要"





















































 京公网安备 11010802027423号
京公网安备 11010802027423号