当前位置:
X-MOL 学术
›
J. Am. Chem. Soc.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
苯酯是酪蛋白水解蛋白酶 P 的强效抑制剂,并揭示了去寡聚化的立体开关
Journal of the American Chemical Society ( IF 14.4 ) Pub Date : 2015-06-29 , DOI: 10.1021/jacs.5b03084 Mathias W. Hackl 1 , Markus Lakemeyer 1 , Maria Dahmen 1 , Manuel Glaser 2 , Axel Pahl 1 , Katrin Lorenz-Baath 1 , Thomas Menzel 1 , Sonja Sievers 3 , Thomas Böttcher 4 , Iris Antes 2 , Herbert Waldmann 3, 5 , Stephan A. Sieber 1
Journal of the American Chemical Society ( IF 14.4 ) Pub Date : 2015-06-29 , DOI: 10.1021/jacs.5b03084 Mathias W. Hackl 1 , Markus Lakemeyer 1 , Maria Dahmen 1 , Manuel Glaser 2 , Axel Pahl 1 , Katrin Lorenz-Baath 1 , Thomas Menzel 1 , Sonja Sievers 3 , Thomas Böttcher 4 , Iris Antes 2 , Herbert Waldmann 3, 5 , Stephan A. Sieber 1
Affiliation
|
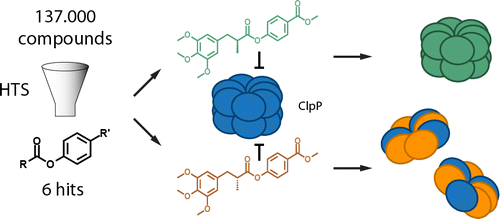
酪蛋白水解蛋白酶 P (ClpP) 是一种参与细胞稳态和致病性的中心细菌降解机制。ClpP 的功能作用已经通过基因敲除和β-内酯的使用进行了研究,β-内酯仍然是迄今为止发现的唯一的 ClpP 特异性抑制剂。β-内酯已作为化学工具在多种生物体中操纵 ClpP;然而,它们的效力、选择性和稳定性是有限的。尽管对 ClpP 活性位点的组成和构象灵活性有详细的结构见解,但迄今为止还没有报道设计特定的非 β-内酯抑制剂的合理努力。在这项工作中,对超过 137 000 种化合物的无偏见筛选用于鉴定五种苯酯化合物作为高效的 ClpP 抑制剂,这些抑制剂对细菌、但不是人类 ClpP。在 ClpP 肽酶和蛋白酶抑制试验中,苯基酯的效力大大超过了 β-内酯,并在活的金黄色葡萄球菌细胞中显示出独特的靶标选择性。分析研究表明,虽然苯基酯像天然肽底物一样被裂解,但它们仍然作为酰基酶中间体共价捕获在活性位点中。36 种衍生物的合成和随后的构效关系 (SAR) 研究提供了对对抑制效力和酰化反应性很重要的保守结构元件的见解。此外,酯的 α 位甲基取代基的立体化学类似于肽底物中的氨基酸侧链,影响 ClpP 复合物的稳定性,导致解离成七聚体或保留十四聚体状态。

"点击查看英文标题和摘要"
更新日期:2015-06-29

"点击查看英文标题和摘要"































 京公网安备 11010802027423号
京公网安备 11010802027423号