当前位置:
X-MOL 学术
›
Nat. Commun.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
GCN5-CITED2-PKA信号模块通过cAMP诱导的底物开关控制肝糖代谢。
Nature Communications ( IF 14.7 ) Pub Date : 2016-11-22 , DOI: 10.1038/ncomms13147
Mashito Sakai , Tomoko Tujimura-Hayakawa , Takashi Yagi , Hiroyuki Yano , Masaru Mitsushima , Hiroyuki Unoki-Kubota , Yasushi Kaburagi , Hiroshi Inoue , Yoshiaki Kido , Masato Kasuga , Michihiro Matsumoto
Nature Communications ( IF 14.7 ) Pub Date : 2016-11-22 , DOI: 10.1038/ncomms13147
Mashito Sakai , Tomoko Tujimura-Hayakawa , Takashi Yagi , Hiroyuki Yano , Masaru Mitsushima , Hiroyuki Unoki-Kubota , Yasushi Kaburagi , Hiroshi Inoue , Yoshiaki Kido , Masato Kasuga , Michihiro Matsumoto
|
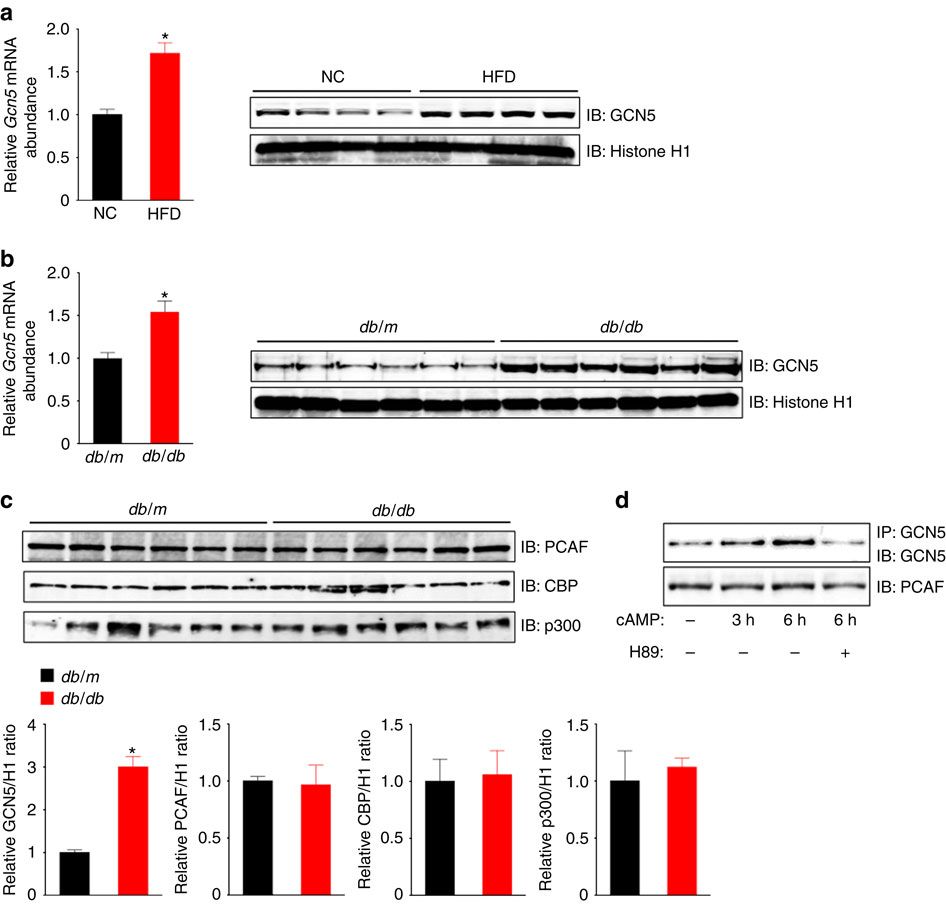
空腹期间的肝糖异生是通过经由胰高血糖素-cAMP-蛋白激酶A(PKA)途径的糖异生基因激活而导致的,该过程的失调是糖尿病中空腹高血糖的基础。这样的转录激活需要通过尚不清楚的机制在启动子上进行表观遗传学改变。在这里,我们显示GCN5既起组蛋白乙酰转移酶(HAT)的作用,以激活空腹糖原异生,又充当乙酰基转移酶的转录共激活物PGC-1α,以抑制进食状态下的糖异生。禁食期间,PKA以依赖转录共调控因子CITED2的方式磷酸化GCN5,从而增加了其对组蛋白的乙酰转移酶活性,并减弱了对PGC-1α的乙酰转移酶活性。此底物开关同时促进与转录激活和PGC-1α介导的共激活相关的表观遗传变化,从而触发糖异生。因此,GCN5-CITED2-PKA信号模块和相关的GCN5底物开关可作为糖异生的关键驱动力。该模块的破坏改善了肥胖糖尿病动物的高血糖症,为此类疾病提供了潜在的治疗策略。

"点击查看英文标题和摘要"
更新日期:2016-11-24

"点击查看英文标题和摘要"

































 京公网安备 11010802027423号
京公网安备 11010802027423号