Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
胰岛素、β-乳球蛋白和 β 淀粉样蛋白中球晶的结构
ACS Omega ( IF 3.7 ) Pub Date : 2016-11-16 00:00:00 , DOI: 10.1021/acsomega.6b00208
Danielle Cannon 1 , Stephen J Eichhorn 2 , Athene M Donald 1
Affiliation
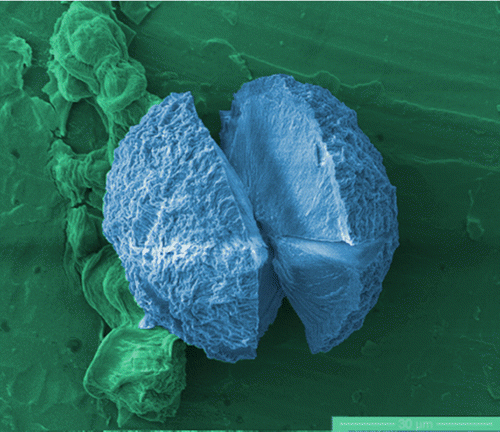
|
在低 pH 值和高温等变性条件下,体外蛋白质可能会错误折叠和聚集,形成称为淀粉样原纤维的长刚性棒;进一步的自组装可以产生更大的结构,称为球晶。这两种聚集体都类似于体内与阿尔茨海默病相关的淀粉样蛋白缠结和斑块。在多种不同的蛋白质中形成这种聚集体的能力表明,这是它们形成机制中的通用能力。人们对这些 5 至 100 微米大球晶的结构以及它们是否可以在淀粉样蛋白 β (1-40) (Aβ40) 中重复形成知之甚少,淀粉样蛋白 β (1-40) (Aβ40) 是一种 40 个氨基酸残基的肽,它是淀粉样蛋白的主要成分之一。阿尔茨海默病淀粉样蛋白沉积物。在这里,我们证明在某些单体化和变性条件下,Aβ40 中很容易形成球晶。使用偏振和非偏振拉曼光谱,我们分析了由三种不同蛋白质形成的球晶的二级结构:胰岛素、β-乳球蛋白 (BLG) 和 Aβ40。通过光学显微镜观察,这些球晶在正交偏光镜下具有特征性的“马耳他十字”结构。然而,我们的结果表明,胰岛素和 Aβ40 球晶具有相似的核心结构,主要由具有辐射原纤维的随机卷曲组成,而 BLG 主要包含 β-折叠和可能从核心螺旋到边缘的原纤维。

"点击查看英文标题和摘要"

































 京公网安备 11010802027423号
京公网安备 11010802027423号