当前位置:
X-MOL 学术
›
J. Am. Chem. Soc.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Relaxation Optimized Heteronuclear Experiments for Extending the Size Limit of RNA Nuclear Magnetic Resonance
Journal of the American Chemical Society ( IF 14.4 ) Pub Date : 2025-03-18 , DOI: 10.1021/jacs.4c17823
Aarsh Shah 1 , Heer Patel 1 , Arjun Kanjarpane 1 , Michael F Summers 1, 2 , Jan Marchant 1
Journal of the American Chemical Society ( IF 14.4 ) Pub Date : 2025-03-18 , DOI: 10.1021/jacs.4c17823
Aarsh Shah 1 , Heer Patel 1 , Arjun Kanjarpane 1 , Michael F Summers 1, 2 , Jan Marchant 1
Affiliation
|
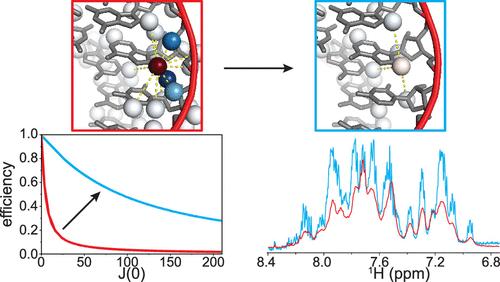
The application of NMR to large RNAs has been limited by the inability to perform heteronuclear correlation experiments essential for resolving overlapping 1H NMR signals, determining interproton distance restraints and interhelical orientations for structure calculations, and evaluating conformational dynamics. Approaches exploiting 1H–13C correlations that are routinely applied to proteins and small RNAs of ∼60 nucleotides or fewer are impractical for larger RNAs due to rapid dipolar relaxation of protons by their attached carbons. Here we report a 2H-enhanced, 1H–15N correlation approach that enables atom-specific NMR characterization of much larger RNAs. Purine H8 transverse relaxation rates are reduced ∼20-fold with ribose perdeuteration, enabling efficient magnetization transfer via two-bond 1H–15N couplings. We focus on H8–N9 correlation spectra which benefit from favorable N9 chemical shift anisotropy. Chemical shift assignment is enabled by retention of protons at the C1′ position, which allow measurement of two-bond H1′–N9 and through-space H1′–H8 correlations with only a minor effect on H8 relaxation. The approach is demonstrated for the 232 nucleotide HIV-1 Rev response element, where chemical shift assignments, 15N-edited nuclear Overhauser effects, and 1H–15N residual dipolar couplings are readily obtained from sensitive, high-resolution spectra. Heteronuclear correlated NMR methods that have been essential for the study of proteins can now be extended to RNAs of at least 78 kDa.
中文翻译:

扩展 RNA 核磁共振大小极限的弛豫优化异核实验
由于无法进行异核相关实验,因此 NMR 在大 RNA 中的应用受到限制,这些实验对于解析重叠的 1H NMR 信号、确定结构计算的质子间距离限制和螺旋间方向以及评估构象动力学至关重要。利用通常应用于蛋白质和 ∼60 个核苷酸或更少的小 RNA 的 1 H-13C 相关性的方法对于较大的 RNA 是不切实际的,因为其附着的碳会快速偶极弛豫质子。在这里,我们报告了一种 2H 增强、1 H-15N 相关方法,该方法能够对更大的 RNA 进行原子特异性 NMR 表征。核糖氘化后,嘌呤 H8 横向弛豫速率降低 ∼20 倍,从而通过双键 1H–15N 耦合实现高效的磁化转移。我们专注于 H8-N9 相关光谱,它受益于良好的 N9 化学位移各向异性。通过在 C1' 位置保留质子来实现化学位移分配,这允许测量双键 H1′–N9 和通过空间 H1′–H8 相关性,对 H8 弛豫的影响很小。该方法针对 232 个核苷酸的 HIV-1 Rev 响应元件进行了演示,其中化学位移分配、15个 N 编辑的核 Overhauser 效应和 1H–15N 残余偶极耦合很容易从敏感的高分辨率光谱中获得。对蛋白质研究至关重要的异核相关 NMR 方法现在可以扩展到至少 78 kDa 的 RNA。
更新日期:2025-03-19
中文翻译:

扩展 RNA 核磁共振大小极限的弛豫优化异核实验
由于无法进行异核相关实验,因此 NMR 在大 RNA 中的应用受到限制,这些实验对于解析重叠的 1H NMR 信号、确定结构计算的质子间距离限制和螺旋间方向以及评估构象动力学至关重要。利用通常应用于蛋白质和 ∼60 个核苷酸或更少的小 RNA 的 1 H-13C 相关性的方法对于较大的 RNA 是不切实际的,因为其附着的碳会快速偶极弛豫质子。在这里,我们报告了一种 2H 增强、1 H-15N 相关方法,该方法能够对更大的 RNA 进行原子特异性 NMR 表征。核糖氘化后,嘌呤 H8 横向弛豫速率降低 ∼20 倍,从而通过双键 1H–15N 耦合实现高效的磁化转移。我们专注于 H8-N9 相关光谱,它受益于良好的 N9 化学位移各向异性。通过在 C1' 位置保留质子来实现化学位移分配,这允许测量双键 H1′–N9 和通过空间 H1′–H8 相关性,对 H8 弛豫的影响很小。该方法针对 232 个核苷酸的 HIV-1 Rev 响应元件进行了演示,其中化学位移分配、15个 N 编辑的核 Overhauser 效应和 1H–15N 残余偶极耦合很容易从敏感的高分辨率光谱中获得。对蛋白质研究至关重要的异核相关 NMR 方法现在可以扩展到至少 78 kDa 的 RNA。

































 京公网安备 11010802027423号
京公网安备 11010802027423号