当前位置:
X-MOL 学术
›
ACS Sustain. Chem. Eng.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Development of a β-Arbutin Hyperproducer in Escherichia coli by Rational Modular and Transcription Factor Engineering
ACS Sustainable Chemistry & Engineering ( IF 7.1 ) Pub Date : 2024-12-18 , DOI: 10.1021/acssuschemeng.4c06838 Shuran Jiang, Xuewei Pan, Xinyu Zhang, Na Wang, Mi Tang, Qisheng Sun, Taowei Yang, Zhiming Rao
ACS Sustainable Chemistry & Engineering ( IF 7.1 ) Pub Date : 2024-12-18 , DOI: 10.1021/acssuschemeng.4c06838 Shuran Jiang, Xuewei Pan, Xinyu Zhang, Na Wang, Mi Tang, Qisheng Sun, Taowei Yang, Zhiming Rao
|
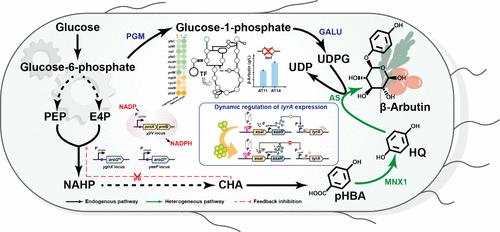
β-Arbutin is a valuable aromatic compound with multiple biological activities. The exploitation of efficient engineering microbial platforms for β-arbutin production has been an appealing research avenue in recent years due to l-tyrosine auxotrophy and the limited distribution of metabolic flux. Herein, an inducer-free and nonauxotrophic cell factory is successfully constructed in Escherichia coli toward high-titer β-arbutin production by combining metabolic engineering strategies. First, the β-arbutin de novo synthesis pathway was constructed, and the expression level of the heterologous enzyme was optimized by promoter engineering. Next, the biosynthetic pathway was modified by rational modular engineering strategies to further enhance β-arbutin production. Subsequently, the transcription factor TorI was identified to negatively regulate β-arbutin biosynthesis based on transcriptomic data. Finally, a dynamic toggle switch controlling the expression of the tyrA gene was designed to reconstruct a nonauxotrophic pathway for β-arbutin production. Without additional supplements of l-tyrosine, the final engineering strain AT25 generated the highest production level ever reported among inducer-free, nonauxotrophic strains, producing 30.52 g/L β-arbutin with a productivity of 0.51 g/L/h. The systematic strategies demonstrated in this study can provide a reference for establishing efficient microbial cell factories for the production of β-arbutin together with other aromatic compounds.
中文翻译:

通过 Rational Modular 和 Transcription Factor Engineering 开发大肠杆菌中的 β-熊果苷超生产者
β-熊果苷是一种有价值的芳香族化合物,具有多种生物活性。由于 l-酪氨酸营养缺陷和代谢通量分布有限,近年来,开发高效的工程微生物平台生产 β-熊果苷一直是一条有吸引力的研究途径。在此,通过结合代谢工程策略,在大肠杆菌中成功构建了一个无诱导剂和非营养型细胞工厂,以实现高滴度 β-熊果苷生产。首先,构建 β-熊果苷从头合成途径,并通过启动子工程优化异源酶的表达水平。接下来,通过合理的模块化工程策略修改生物合成途径,以进一步提高 β-熊果苷的产生。随后,根据转录组学数据鉴定出转录因子 TorI 负向调节 β-熊果苷生物合成。最后,设计了一个控制 tyrA 基因表达的动态拨动开关,以重建 β-熊果苷产生的非营养缺陷型途径。在没有额外补充 l-酪氨酸的情况下,最终的工程菌株 AT25 在无诱导剂、非营养缺陷型菌株中产生了有史以来最高的生产水平,产生 30.52 g/L β-熊果苷,生产率为 0.51 g/L/h。本研究论述的系统策略可为建立高效的微生物细胞工厂提供参考,以生产 β-熊果苷和其他芳香族化合物。
更新日期:2024-12-18
中文翻译:

通过 Rational Modular 和 Transcription Factor Engineering 开发大肠杆菌中的 β-熊果苷超生产者
β-熊果苷是一种有价值的芳香族化合物,具有多种生物活性。由于 l-酪氨酸营养缺陷和代谢通量分布有限,近年来,开发高效的工程微生物平台生产 β-熊果苷一直是一条有吸引力的研究途径。在此,通过结合代谢工程策略,在大肠杆菌中成功构建了一个无诱导剂和非营养型细胞工厂,以实现高滴度 β-熊果苷生产。首先,构建 β-熊果苷从头合成途径,并通过启动子工程优化异源酶的表达水平。接下来,通过合理的模块化工程策略修改生物合成途径,以进一步提高 β-熊果苷的产生。随后,根据转录组学数据鉴定出转录因子 TorI 负向调节 β-熊果苷生物合成。最后,设计了一个控制 tyrA 基因表达的动态拨动开关,以重建 β-熊果苷产生的非营养缺陷型途径。在没有额外补充 l-酪氨酸的情况下,最终的工程菌株 AT25 在无诱导剂、非营养缺陷型菌株中产生了有史以来最高的生产水平,产生 30.52 g/L β-熊果苷,生产率为 0.51 g/L/h。本研究论述的系统策略可为建立高效的微生物细胞工厂提供参考,以生产 β-熊果苷和其他芳香族化合物。































 京公网安备 11010802027423号
京公网安备 11010802027423号