当前位置:
X-MOL 学术
›
Anal. Chim. Acta
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Turning waste into wealth: Enzyme-activated DNA sensor based on reactant recycle for spatially selective imaging microRNA toward target cells
Analytica Chimica Acta ( IF 5.7 ) Pub Date : 2024-12-16 , DOI: 10.1016/j.aca.2024.343557 Yaokun Xia, Guomin Ju, Yongting Zhou, Xiao Li, Yufei Luo, Chuanhui Peng, Xueling Liu
中文翻译:

变废为宝:基于反应物回收的酶激活 DNA 传感器,用于对目标细胞进行 MicroRNA 空间选择性成像
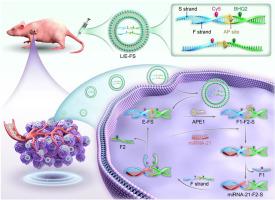
癌细胞中 microRNA (miRNA) 的扩增成像对于了解潜在的病理过程至关重要。合成催化 DNA 回路是 miRNA 成像的关键工具。然而,现有的大多数催化 DNA 回路无法实现细胞和体内的反应物回收操作。此外,肿瘤部位的特异性 miRNA 成像也是一项挑战。在此,受“变废为宝”的启发,我们报道了一种基于脱嘌呤/脱嘧啶核酸内切酶 1 (APE1) 激活的反应物回收催化 DNA 回路的 DNA 传感器,用于靶细胞中 miRNA 的成像。
DNA 传感器的传感功能首先通过设计脱嘌呤/无嘧啶 (AP) 位点来抑制。在 APE1 存在下,AP 位点发生水解,从而在 miRNA 协助下激活感应活性并触发链置换反应 (SDR)。在这个催化 DNA 回路中,当双链废液转化为活性组分时,可以启动下一个反应循环,这使得它可以连续进行,只需消耗燃料 DNA,而不会耗尽反应物。值得注意的是,脂质体在克服核酸递送的生物障碍中起着重要作用。该 DNA 传感器在体内进行扩增的 miRNA 成像策略,在 APE1 的辅助下减少肿瘤外信号,与传统催化 DNA 回路相比,增强了肿瘤与正常组织的对比。
首先,开发了 APE1 激活的反应物回收催化 DNA 回路。其次,在细胞和动物中实现 miRNA 成像,具有很高的空间选择性。第三,在体外和体内成像的信噪比得到改善。最后,我们的策略提供了一种自动化但通用的方法,用于开发更高效和选择性的 DNA 回路,能够将癌细胞中的 miRNA 与正常细胞中的 miRNA 区分开来,有望在癌症诊断中具有价值。
更新日期:2024-12-21
Analytica Chimica Acta ( IF 5.7 ) Pub Date : 2024-12-16 , DOI: 10.1016/j.aca.2024.343557 Yaokun Xia, Guomin Ju, Yongting Zhou, Xiao Li, Yufei Luo, Chuanhui Peng, Xueling Liu
|
Background
Amplified imaging of microRNA (miRNA) in cancer cells is essential for understanding of the underlying pathological process. Synthetic catalytic DNA circuits represent pivotal tools for miRNA imaging. However, most existing catalytic DNA circuits can not achieve the reactant recycling operation in cells and in vivo. Additionally, specificity miRNA imaging in tumor site also is a challenge. Herein, inspired by “turning waste into wealth”, we report a DNA sensor for imaging of miRNA in target cells based on apurinic/apyrimidinic endonuclease 1 (APE1)-activated reactant recycling catalytic DNA circuit.Results
The sensing function of the DNA sensor is suppressed firstly through engineering an apurinic/apyrimidinic (AP) site. In the presence of APE1, the AP site undergoes hydrolysis, thereby activating sensing activity and triggering the strand displacement reaction (SDR) under miRNA assistance. In this catalytic DNA circuit, the next reaction cycle can be initiated when the duplex strand waste products are reverted into active components, which allows it to be performed continuously just consuming fuel DNA without depleting the reactant. Noteworthy, the liposome plays important role in overcome biological barriers for nucleic acid delivery. The amplified miRNA imaging strategy is carried out in vivo by this DNA sensor with reducing off-tumor signal under assistance with APE1, and enhances tumor-to-normal tissue contrast compared with traditional catalytic DNA circuit.Significance and novelty
Firstly, APE1-activated reactant recycling catalytic DNA circuit is developed. Secondly, miRNA image in cell and in animal is achieved with high spatial selectivity. Thirdly, the signal-to-background ratio for imaging is improved in vitro and in vivo. Lastly, our strategy provides an automatic yet versatile approach for the development of more efficient and selective DNA circuits capable of differentiating miRNA in cancer cells from those in normal cells, promising to be valuable in cancer diagnosis.中文翻译:

变废为宝:基于反应物回收的酶激活 DNA 传感器,用于对目标细胞进行 MicroRNA 空间选择性成像
背景
癌细胞中 microRNA (miRNA) 的扩增成像对于了解潜在的病理过程至关重要。合成催化 DNA 回路是 miRNA 成像的关键工具。然而,现有的大多数催化 DNA 回路无法实现细胞和体内的反应物回收操作。此外,肿瘤部位的特异性 miRNA 成像也是一项挑战。在此,受“变废为宝”的启发,我们报道了一种基于脱嘌呤/脱嘧啶核酸内切酶 1 (APE1) 激活的反应物回收催化 DNA 回路的 DNA 传感器,用于靶细胞中 miRNA 的成像。
结果
DNA 传感器的传感功能首先通过设计脱嘌呤/无嘧啶 (AP) 位点来抑制。在 APE1 存在下,AP 位点发生水解,从而在 miRNA 协助下激活感应活性并触发链置换反应 (SDR)。在这个催化 DNA 回路中,当双链废液转化为活性组分时,可以启动下一个反应循环,这使得它可以连续进行,只需消耗燃料 DNA,而不会耗尽反应物。值得注意的是,脂质体在克服核酸递送的生物障碍中起着重要作用。该 DNA 传感器在体内进行扩增的 miRNA 成像策略,在 APE1 的辅助下减少肿瘤外信号,与传统催化 DNA 回路相比,增强了肿瘤与正常组织的对比。
意义和新颖性
首先,开发了 APE1 激活的反应物回收催化 DNA 回路。其次,在细胞和动物中实现 miRNA 成像,具有很高的空间选择性。第三,在体外和体内成像的信噪比得到改善。最后,我们的策略提供了一种自动化但通用的方法,用于开发更高效和选择性的 DNA 回路,能够将癌细胞中的 miRNA 与正常细胞中的 miRNA 区分开来,有望在癌症诊断中具有价值。






























 京公网安备 11010802027423号
京公网安备 11010802027423号