当前位置:
X-MOL 学术
›
Anal. Chem.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Improving Glycoproteomic Analysis Workflow by Systematic Evaluation of Glycopeptide Enrichment, Quantification, Mass Spectrometry Approach, and Data Analysis Strategies
Analytical Chemistry ( IF 6.7 ) Pub Date : 2024-12-16 , DOI: 10.1021/acs.analchem.4c04466 Zhenyu Sun, T. Mamie Lih, Jongmin Woo, Liyuan Jiao, Yingwei Hu, Yuefan Wang, Hongyi Liu, Hui Zhang
Analytical Chemistry ( IF 6.7 ) Pub Date : 2024-12-16 , DOI: 10.1021/acs.analchem.4c04466 Zhenyu Sun, T. Mamie Lih, Jongmin Woo, Liyuan Jiao, Yingwei Hu, Yuefan Wang, Hongyi Liu, Hui Zhang
|
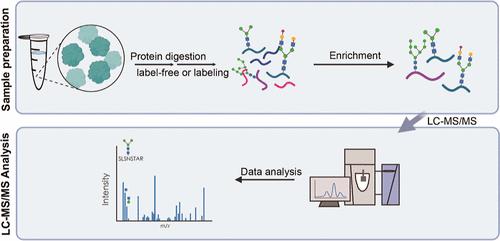
Glycosylation is one of the most prevalent and crucial protein modifications. Quantitative site-specific characterization of glycosylation usually requires sophisticated intact glycopeptide analysis using glycoproteomics. Recent efforts have focused on the interrogation of intact glycopeptide analyses using tandem mass spectrometry. However, a systematic evaluation of the quantitative glycoproteomic workflow is still lacking. This study compared different strategies for glycopeptide enrichment alongside glycopeptide quantitation, as well as mass spectrometry and data analysis strategies, providing a comprehensive assessment of their efficacy. The ZIC-HILIC enrichment method demonstrated superior performance, representing a 26% improvement in identified glycopeptiudes compared to the MAX enrichment method. Quantification using TMT provided high precision and throughput with an average CV of 8%. Through systematic evaluation, this study established that the ZIC-HILIC enrichment method, quantification with TMT, and collision energies of 25, 35, and 45 using tandem mass spectrometry are the optimal workflow for higher-energy collisional dissociation (HCD) fragmentation, significantly enhancing the analysis of intact glycopeptides. Precise energy adjustment is crucial for the identification of certain glycans. Intact glycopeptides were analyzed using different software tools to investigate the identification and quantification of glycopeptides. By applying optimal settings, 5514 unique intact glycopeptides were in luminal and basal patient-derived xenograft (PDX) characterized models, highlighting distinct glycosylation profiles that may influence tumor behavior. This study offers a systematic approach to evaluate glycoproteomic analysis workflow.
中文翻译:

通过系统评估糖肽富集、定量、质谱方法和数据分析策略来改进糖蛋白质组学分析工作流程
糖基化是最普遍和最关键的蛋白质修饰之一。糖基化的定量位点特异性表征通常需要使用糖蛋白质组学进行复杂的完整糖肽分析。最近的工作集中在使用串联质谱法对完整糖肽分析进行询问。然而,仍然缺乏对定量糖蛋白组学工作流程的系统评价。本研究比较了糖肽富集和糖肽定量的不同策略,以及质谱和数据分析策略,对其疗效进行了全面评估。ZIC-HILIC 富集方法表现出优异的性能,与 MAX 富集方法相比,鉴定出的糖肽提高了 26%。使用 TMT 进行定量可提供高精度和通量,平均 CV 为 8%。通过系统评价,本研究确定 ZIC-HILIC 富集方法、TMT 定量以及使用串联质谱法的 25、35 和 45 碰撞能量是高能碰撞解离 (HCD) 碎裂的最佳工作流程,显着增强了完整糖肽的分析。精确的能量调整对于鉴定某些游离寡糖至关重要。使用不同的软件工具分析完整的糖肽,以研究糖肽的鉴定和定量。通过应用最佳设置,在管腔和基底患者来源的异种移植物 (PDX) 特征模型中发现了 5514 种独特的完整糖肽,突出了可能影响肿瘤行为的不同糖基化特征。本研究提供了一种评估糖蛋白质组学分析工作流程的系统方法。
更新日期:2024-12-16
中文翻译:

通过系统评估糖肽富集、定量、质谱方法和数据分析策略来改进糖蛋白质组学分析工作流程
糖基化是最普遍和最关键的蛋白质修饰之一。糖基化的定量位点特异性表征通常需要使用糖蛋白质组学进行复杂的完整糖肽分析。最近的工作集中在使用串联质谱法对完整糖肽分析进行询问。然而,仍然缺乏对定量糖蛋白组学工作流程的系统评价。本研究比较了糖肽富集和糖肽定量的不同策略,以及质谱和数据分析策略,对其疗效进行了全面评估。ZIC-HILIC 富集方法表现出优异的性能,与 MAX 富集方法相比,鉴定出的糖肽提高了 26%。使用 TMT 进行定量可提供高精度和通量,平均 CV 为 8%。通过系统评价,本研究确定 ZIC-HILIC 富集方法、TMT 定量以及使用串联质谱法的 25、35 和 45 碰撞能量是高能碰撞解离 (HCD) 碎裂的最佳工作流程,显着增强了完整糖肽的分析。精确的能量调整对于鉴定某些游离寡糖至关重要。使用不同的软件工具分析完整的糖肽,以研究糖肽的鉴定和定量。通过应用最佳设置,在管腔和基底患者来源的异种移植物 (PDX) 特征模型中发现了 5514 种独特的完整糖肽,突出了可能影响肿瘤行为的不同糖基化特征。本研究提供了一种评估糖蛋白质组学分析工作流程的系统方法。






























 京公网安备 11010802027423号
京公网安备 11010802027423号