当前位置:
X-MOL 学术
›
Mol. Nutr. Food Res.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
An Optimized Ex Vivo n–3 PUFA Supplementation Strategy for Primary Human Macrophages Shows That DHA Suppresses Prostaglandin E2 Formation
Molecular Nutrition & Food Research ( IF 4.5 ) Pub Date : 2024-12-16 , DOI: 10.1002/mnfr.202400716 Rebecca Kirchhoff, Nadja Kampschulte, Carina Rothweiler, Nadine Rohwer, Karsten‐Henrich Weylandt, Nils Helge Schebb
Molecular Nutrition & Food Research ( IF 4.5 ) Pub Date : 2024-12-16 , DOI: 10.1002/mnfr.202400716 Rebecca Kirchhoff, Nadja Kampschulte, Carina Rothweiler, Nadine Rohwer, Karsten‐Henrich Weylandt, Nils Helge Schebb
|
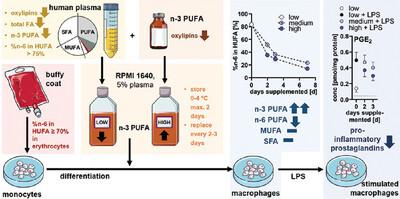
Evidence suggests beneficial effects of long‐chain n –3 polyunsaturated fatty acids (PUFAs) in inflammatory diseases. However, the underlying mechanisms are still subject of research. For this purpose, we developed an ex vivo n –3 PUFA supplementation strategy. M2‐like macrophages were supplemented for 2–3 days with 20–40 µM docosahexaenoic acid (DHA) during differentiation. Quality parameters include <3% oxylipins for PUFA‐preparation, total fatty acids (FAs) <10 mM, and low oxylipins in plasma, n –3 PUFA <0.25 mM for the selection of donors of plasma as well as %n –6 in highly unsaturated fatty acids (HUFAs) ≥70% for donors of cells. Following supplementation, PUFA pattern of cells was shifted toward one described for blood and tissue from subjects with higher n –3 and lower n –6 PUFAs. This was accompanied by a decrease of arachidonic acid‐derived oxylipins in a dose‐ and time‐dependent manner in favor of n –3 PUFA ones. Stimulation with LPS resulted in decreased levels of pro‐inflammatory prostaglandins in the DHA‐supplemented cells, but no changes in cytokines. In vitro supplementation studies with n –3 PUFA need rigorous controls to exclude the background formation of oxylipins. By accounting for these possible confounders the described approach allows the mechanistic investigation of n –3 PUFAs in primary human immune cells, offering an alternative for intervention studies.
中文翻译:

针对原代人巨噬细胞的优化体外 n-3 PUFA 补充策略显示,DHA 抑制前列腺素 E2 的形成
有证据表明,长链 n-3 多不饱和脂肪酸 (PUFA) 对炎症性疾病有益。然而,潜在的机制仍然是研究的主题。为此,我们开发了一种离体 n-3 PUFA 补充策略。在分化过程中,向 M2 样巨噬细胞补充 20-40 μM 二十二碳六烯酸 (DHA) 2-3 天。质量参数包括用于 PUFA 制备的 <3% 脂氧化物、总脂肪酸 (FA) <10 mM 和血浆中的低脂氧化物、用于选择血浆供体的 n-3 PUFA <0.25 mM,以及高度不饱和脂肪酸 (HUFA) 中的 %n-6 ≥70% 用于细胞供体。补充后,细胞的 PUFA 模式转变为 n-3 较高和 n-6 PUFA 较低的受试者的血液和组织模式。这伴随着花生四烯酸衍生的脂氧化物以剂量和时间依赖性方式减少,有利于 n-3 个 PUFA 的。用 LPS 刺激导致补充 DHA 的细胞中促炎前列腺素水平降低,但细胞因子没有变化。使用 n-3 PUFA 的体外补充剂研究需要严格的控制,以排除氧磷脂的背景形成。通过考虑这些可能的混杂因素,所描述的方法允许对原代人类免疫细胞中的 n-3 个 PUFA 进行机制研究,为干预研究提供了替代方案。
更新日期:2024-12-16
中文翻译:

针对原代人巨噬细胞的优化体外 n-3 PUFA 补充策略显示,DHA 抑制前列腺素 E2 的形成
有证据表明,长链 n-3 多不饱和脂肪酸 (PUFA) 对炎症性疾病有益。然而,潜在的机制仍然是研究的主题。为此,我们开发了一种离体 n-3 PUFA 补充策略。在分化过程中,向 M2 样巨噬细胞补充 20-40 μM 二十二碳六烯酸 (DHA) 2-3 天。质量参数包括用于 PUFA 制备的 <3% 脂氧化物、总脂肪酸 (FA) <10 mM 和血浆中的低脂氧化物、用于选择血浆供体的 n-3 PUFA <0.25 mM,以及高度不饱和脂肪酸 (HUFA) 中的 %n-6 ≥70% 用于细胞供体。补充后,细胞的 PUFA 模式转变为 n-3 较高和 n-6 PUFA 较低的受试者的血液和组织模式。这伴随着花生四烯酸衍生的脂氧化物以剂量和时间依赖性方式减少,有利于 n-3 个 PUFA 的。用 LPS 刺激导致补充 DHA 的细胞中促炎前列腺素水平降低,但细胞因子没有变化。使用 n-3 PUFA 的体外补充剂研究需要严格的控制,以排除氧磷脂的背景形成。通过考虑这些可能的混杂因素,所描述的方法允许对原代人类免疫细胞中的 n-3 个 PUFA 进行机制研究,为干预研究提供了替代方案。






























 京公网安备 11010802027423号
京公网安备 11010802027423号