当前位置:
X-MOL 学术
›
J. Agric. Food Chem.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
A Crystal Structure of Pro c 2 Provides Insights into Cross-Reactivity of Aquatic Allergens from the Phosphagen Kinase Family
Journal of Agricultural and Food Chemistry ( IF 5.7 ) Pub Date : 2024-12-11 , DOI: 10.1021/acs.jafc.4c09727 Yang Yang, Xin-Rong He, Fei Huan, Tian-Liang Bai, Qi-Hui Zhang, Fa-Jie Li, Gui-Xia Chen, Pei-Yi Zheng, Li-Mei Xu, Guang-Ming Liu
Journal of Agricultural and Food Chemistry ( IF 5.7 ) Pub Date : 2024-12-11 , DOI: 10.1021/acs.jafc.4c09727 Yang Yang, Xin-Rong He, Fei Huan, Tian-Liang Bai, Qi-Hui Zhang, Fa-Jie Li, Gui-Xia Chen, Pei-Yi Zheng, Li-Mei Xu, Guang-Ming Liu
|
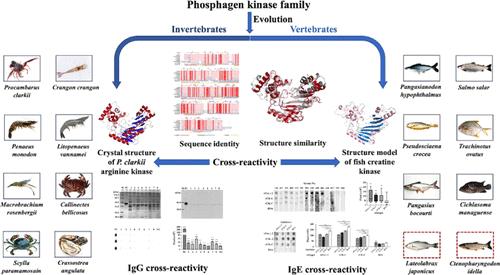
Arginine kinase (AK) from the phosphagen kinase family is a cross-reactive shellfish allergen. Structurally related cross-reactive allergens are involved in the pathogenesis of allergic symptoms. This study aimed to unravel the cross-reactivity of AK from a structural perspective. The crystal structure of Procambarus clarkii AK (Pro c 2) was resolved at 1.57 Å resolution, which showed a well-conserved structure not only to shellfish AKs but also to fish creatine kinase (CK), another allergen from the phosphagen kinase family. In Western blot, the CK corresponding protein in fish muscles was found to be reactive with AK-specific immunoglobulin (Ig) G. Recombinant Pro c 2 (rPro c 2) and CKs from Lateolabrax japonicus (rCK-L) and Ctenopharyngodon idell (rCK-C) were then produced, and the IgE reactivity of rCK-L and rCK-C, as well as their IgG/IgE cross-reactivity with rPro c 2, was confirmed by immunological assays. This study demonstrated the cross-reactivity among aquatic allergens from the phosphagen kinase family due to their structural similarity.
中文翻译:

Pro c 2 的晶体结构为了解磷化原激酶家族的水生过敏原的交叉反应性提供了见解
来自磷酸酶激酶家族的精氨酸激酶 (AK) 是一种交叉反应性贝类过敏原。结构相关的交叉反应性过敏原参与过敏症状的发病机制。本研究旨在从结构角度揭示 AK 的交叉反应性。Procambarus clarkii AK (Pro c 2) 的晶体结构以 1.57 Å 的分辨率分离,这不仅对贝类 AK 显示出很好的保守结构,而且对鱼肌酸激酶 (CK),另一种来自磷酸酶原激酶家族的过敏原也显示出良好的结构。在 Western blot 中,发现鱼肌肉中的 CK 相应蛋白与 AK 特异性免疫球蛋白 (Ig) G 反应,然后产生重组 Pro c 2 (rPro c 2) 和来自日本乳胶 (rCK-L) 和肌咽管顿 (rCK-C) 的 CKs,以及 rCK-L 和 rCK-C 的 IgE 反应性,以及它们与 rPro c 2 的 IgG/IgE 交叉反应性,均通过免疫学测定得到证实。这项研究表明,由于磷酸酶激酶家族的水生过敏原的结构相似性,它们之间存在交叉反应性。
更新日期:2024-12-11
中文翻译:

Pro c 2 的晶体结构为了解磷化原激酶家族的水生过敏原的交叉反应性提供了见解
来自磷酸酶激酶家族的精氨酸激酶 (AK) 是一种交叉反应性贝类过敏原。结构相关的交叉反应性过敏原参与过敏症状的发病机制。本研究旨在从结构角度揭示 AK 的交叉反应性。Procambarus clarkii AK (Pro c 2) 的晶体结构以 1.57 Å 的分辨率分离,这不仅对贝类 AK 显示出很好的保守结构,而且对鱼肌酸激酶 (CK),另一种来自磷酸酶原激酶家族的过敏原也显示出良好的结构。在 Western blot 中,发现鱼肌肉中的 CK 相应蛋白与 AK 特异性免疫球蛋白 (Ig) G 反应,然后产生重组 Pro c 2 (rPro c 2) 和来自日本乳胶 (rCK-L) 和肌咽管顿 (rCK-C) 的 CKs,以及 rCK-L 和 rCK-C 的 IgE 反应性,以及它们与 rPro c 2 的 IgG/IgE 交叉反应性,均通过免疫学测定得到证实。这项研究表明,由于磷酸酶激酶家族的水生过敏原的结构相似性,它们之间存在交叉反应性。






























 京公网安备 11010802027423号
京公网安备 11010802027423号