Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Refractive Index Morphology Imaging Microscope System Utilizing Polarization Multiplexing for Label-Free Single Living Cells
ACS Sensors ( IF 8.2 ) Pub Date : 2024-12-09 , DOI: 10.1021/acssensors.4c02484 Huijun Wang, Lu Zhang, Chen Fan, Jie Huang, Weihao Zhao, Zewen Yang, Lifang Tian, Hong Zhao, Cuiping Yao
ACS Sensors ( IF 8.2 ) Pub Date : 2024-12-09 , DOI: 10.1021/acssensors.4c02484 Huijun Wang, Lu Zhang, Chen Fan, Jie Huang, Weihao Zhao, Zewen Yang, Lifang Tian, Hong Zhao, Cuiping Yao
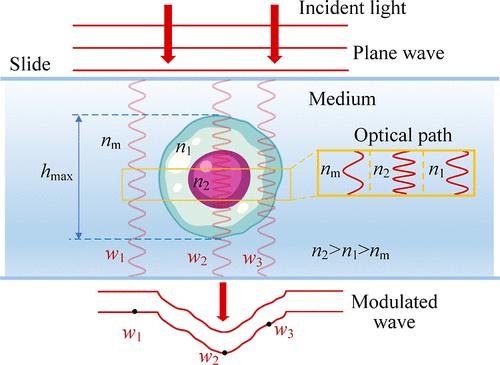
|
Detections of internal substances and morphologies for label-free living cells are crucial for revealing malignant diseases. With the phase serving as a coupling of refractive index (RI) (marker for substances) and thickness (morphology), existing decoupling methods mainly rely on complex integrated systems or extensive optical field information. Developing simple and rapid decoupling methods remains a challenge. This study introduces a refractive index morphology imaging microscope (RIMIM) system utilizing polarization multiplexing for label-free single living cells. By simultaneous degree of circular polarization (DOCP) imaging and noninterferometric quantitative phase imaging (QPI), the intracellular refractive index distribution (IRID) and morphology can be decoupled. The optical thickness calculated from the phase is input into the circular depolarization decay model (CDDM) of degree of circular polarization to retrieve IRID. Subsequently, the thickness can be decoupled from phase result using retrieved IRID. Experiments conducted on mouse forestomach carcinoma (MFC) cells and human kidney-2 cells (HK-2) demonstrated the RIMIM system’s ability to retrieve IRID and decouple fine morphology. Additionally, the RIMIM system effectively detected membrane damage and changes in erastin-induced ferroptotic HK-2 cells, with average and root-mean-square of surface folds 65.5% and 70.0% higher than those of normal HK-2 cells. Overall, the RIMIM system provides a simple and rapid method for decoupling RI and fine morphology, showing great potential for label-free live cells’ cytopathology detection.
中文翻译:

利用偏振多路复用检测无标记单个活细胞的折射率形态学成像显微镜系统
检测无标记活细胞的内部物质和形态对于揭示恶性疾病至关重要。由于相位是折射率 (RI)(物质的标志物)和厚度(形态)的耦合,现有的去耦方法主要依赖于复杂的集成系统或广泛的光场信息。开发简单快速的解耦方法仍然是一个挑战。本研究介绍了一种折射率形态学成像显微镜 (RIMIM) 系统,该系统利用偏振多路复用技术检测无标记的单个活细胞。通过同时进行圆偏振度 (DOCP) 成像和非干涉定量相位成像 (QPI),可以解耦细胞内折射率分布 (IRID) 和形态。根据相位计算的光学厚度被输入到圆偏振度数的圆去偏振衰减模型 (CDDM) 中,以检索 IRID。随后,可以使用检索到的 IRID 将厚度与相位结果解耦。对小鼠前胃癌 (MFC) 细胞和人肾 2 细胞 (HK-2) 进行的实验证明了 RIMIM 系统检索 IRID 和解耦精细形态的能力。此外,RIMIM 系统有效检测 erastin 诱导的铁死亡 HK-2 细胞的膜损伤和变化,表面折叠的平均和均方根比正常 HK-2 细胞高 65.5% 和 70.0%。总体而言,RIMIM 系统提供了一种简单快速的 RI 和精细形态解耦方法,在无标记活细胞细胞病理学检测方面显示出巨大潜力。
更新日期:2024-12-09
中文翻译:

利用偏振多路复用检测无标记单个活细胞的折射率形态学成像显微镜系统
检测无标记活细胞的内部物质和形态对于揭示恶性疾病至关重要。由于相位是折射率 (RI)(物质的标志物)和厚度(形态)的耦合,现有的去耦方法主要依赖于复杂的集成系统或广泛的光场信息。开发简单快速的解耦方法仍然是一个挑战。本研究介绍了一种折射率形态学成像显微镜 (RIMIM) 系统,该系统利用偏振多路复用技术检测无标记的单个活细胞。通过同时进行圆偏振度 (DOCP) 成像和非干涉定量相位成像 (QPI),可以解耦细胞内折射率分布 (IRID) 和形态。根据相位计算的光学厚度被输入到圆偏振度数的圆去偏振衰减模型 (CDDM) 中,以检索 IRID。随后,可以使用检索到的 IRID 将厚度与相位结果解耦。对小鼠前胃癌 (MFC) 细胞和人肾 2 细胞 (HK-2) 进行的实验证明了 RIMIM 系统检索 IRID 和解耦精细形态的能力。此外,RIMIM 系统有效检测 erastin 诱导的铁死亡 HK-2 细胞的膜损伤和变化,表面折叠的平均和均方根比正常 HK-2 细胞高 65.5% 和 70.0%。总体而言,RIMIM 系统提供了一种简单快速的 RI 和精细形态解耦方法,在无标记活细胞细胞病理学检测方面显示出巨大潜力。

































 京公网安备 11010802027423号
京公网安备 11010802027423号