Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Ion coupling and inhibitory mechanisms of the human presynaptic high-affinity choline transporter CHT1
Structure ( IF 4.4 ) Pub Date : 2024-12-09 , DOI: 10.1016/j.str.2024.11.009 Yunlong Qiu, Yiwei Gao, Qinru Bai, Yan Zhao
Structure ( IF 4.4 ) Pub Date : 2024-12-09 , DOI: 10.1016/j.str.2024.11.009 Yunlong Qiu, Yiwei Gao, Qinru Bai, Yan Zhao
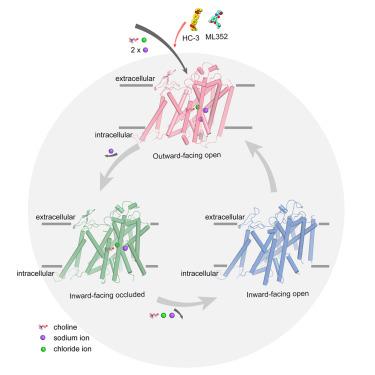
|
In cholinergic neurons, choline is the precursor of the excitatory neurotransmitter acetylcholine (ACh), which plays a fundamental role in the brain. The high-affinity choline transporter, CHT1, mediates the efficient recycling of choline to facilitate ACh synthesis in the presynapse. Here, we report high-resolution cryoelectron microscopic (cryo-EM) structures of CHT1 in complex with the inhibitors HC-3 and ML352, the substrate choline, and a substrate-free state. Our structures show distinct binding modes of the inhibitors with different chemical structures, revealing their inhibition mechanisms. Additionally, we observed a chloride ion that directly interacts with the substrate choline, thereby stabilizing its binding with CHT1. Two sodium ions, Na2 and Na3, were clearly identified, which we speculate might be involved in substrate binding and conformational transitions, respectively. Our structures provide molecular insights into the coupling mechanism of ion binding with substrate binding and conformational transitions, promoting our understanding of the ion-coupled substrate transport mechanism.
中文翻译:

人突触前高亲和力胆碱转运蛋白 CHT1 的离子偶联和抑制机制
在胆碱能神经元中,胆碱是兴奋性神经递质乙酰胆碱 (ACh) 的前体,乙酰胆碱在大脑中起着重要作用。高亲和力胆碱转运蛋白 CHT1 介导胆碱的有效再循环,以促进突触前中的 ACh 合成。在这里,我们报道了 CHT1 与抑制剂 HC-3 和 ML352、底物胆碱和无底物状态复合的高分辨率冷冻电子显微镜 (cryo-EM) 结构。我们的结构显示了具有不同化学结构的抑制剂的不同结合模式,揭示了它们的抑制机制。此外,我们观察到一种氯离子直接与底物胆碱相互作用,从而稳定其与 CHT1 的结合。明确鉴定了两种钠离子 Na2 和 Na3,我们推测它们可能分别参与底物结合和构象转换。我们的结构为离子结合与底物结合和构象转变的偶联机制提供了分子见解,促进了我们对离子偶联底物转运机制的理解。
更新日期:2024-12-09
中文翻译:

人突触前高亲和力胆碱转运蛋白 CHT1 的离子偶联和抑制机制
在胆碱能神经元中,胆碱是兴奋性神经递质乙酰胆碱 (ACh) 的前体,乙酰胆碱在大脑中起着重要作用。高亲和力胆碱转运蛋白 CHT1 介导胆碱的有效再循环,以促进突触前中的 ACh 合成。在这里,我们报道了 CHT1 与抑制剂 HC-3 和 ML352、底物胆碱和无底物状态复合的高分辨率冷冻电子显微镜 (cryo-EM) 结构。我们的结构显示了具有不同化学结构的抑制剂的不同结合模式,揭示了它们的抑制机制。此外,我们观察到一种氯离子直接与底物胆碱相互作用,从而稳定其与 CHT1 的结合。明确鉴定了两种钠离子 Na2 和 Na3,我们推测它们可能分别参与底物结合和构象转换。我们的结构为离子结合与底物结合和构象转变的偶联机制提供了分子见解,促进了我们对离子偶联底物转运机制的理解。






























 京公网安备 11010802027423号
京公网安备 11010802027423号