Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
DNA hypomethylation promotes UHRF1-and SUV39H1/H2-dependent crosstalk between H3K18ub and H3K9me3 to reinforce heterochromatin states
Molecular Cell ( IF 14.5 ) Pub Date : 2024-12-03 , DOI: 10.1016/j.molcel.2024.11.009 Yanqing Liu, Joel A. Hrit, Alison A. Chomiak, Stephanie Stransky, Jordan R. Hoffman, Rochelle L. Tiedemann, Ashley K. Wiseman, Leena S. Kariapper, Bradley M. Dickson, Evan J. Worden, Christopher J. Fry, Simone Sidoli, Scott B. Rothbart
Molecular Cell ( IF 14.5 ) Pub Date : 2024-12-03 , DOI: 10.1016/j.molcel.2024.11.009 Yanqing Liu, Joel A. Hrit, Alison A. Chomiak, Stephanie Stransky, Jordan R. Hoffman, Rochelle L. Tiedemann, Ashley K. Wiseman, Leena S. Kariapper, Bradley M. Dickson, Evan J. Worden, Christopher J. Fry, Simone Sidoli, Scott B. Rothbart
|
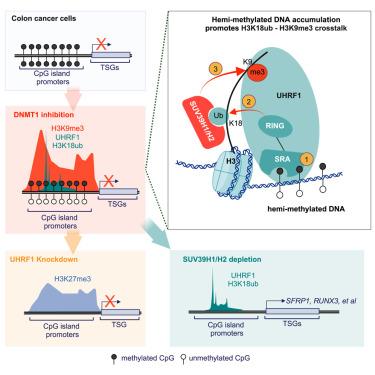
Mono-ubiquitination of lysine 18 on histone H3 (H3K18ub), catalyzed by UHRF1, is a DNMT1 docking site that facilitates replication-coupled DNA methylation maintenance. Its functions beyond this are unknown. Here, we genomically map simultaneous increases in UHRF1-dependent H3K18ub and SUV39H1/H2-dependent H3K9me3 following DNMT1 inhibition. Mechanistically, transient accumulation of hemi-methylated DNA at CpG islands facilitates UHRF1 recruitment and E3 ligase activity toward H3K18. Notably, H3K18ub enhances SUV39H1/H2 methyltransferase activity and, in colon cancer cells, nucleates new H3K9me3 domains at CpG island promoters of DNA methylation-silenced tumor suppressor genes (TSGs). Disrupting UHRF1 enzyme activity prevents H3K9me3 accumulation while promoting PRC2-dependent H3K27me3 as a tertiary layer of gene repression in these regions. By contrast, disrupting H3K18ub-dependent SUV39H1/H2 activity enhances the transcriptional activating and antiproliferative effects of DNMT1 inhibition. Collectively, these findings reveal roles for UHRF1 and H3K18ub in regulating a hierarchy of repressive histone methylation signaling and rationalize a combination strategy for epigenetic cancer therapy.
中文翻译:

DNA 低甲基化促进 H3K18ub 和 H3K9me3 之间 UHRF1 和 SUV39H1/H2 依赖性串扰,以增强异染色质状态
由 UHRF1 催化的组蛋白 H3 (H3K18ub) 上赖氨酸 18 的单泛素化是一个 DNMT1 停靠位点,可促进复制偶联 DNA 甲基化维持。除此之外,它的功能尚不清楚。在这里,我们基因组地绘制了 DNMT1 抑制后 UHRF1 依赖性 H3K18ub 和 SUV39H1/H2 依赖性 H3K9me3 同时增加。从机制上讲,半甲基化 DNA 在 CpG 岛的瞬时积累促进了 UHRF1 募集和 E3 连接酶对 H3K18 的活性。值得注意的是,H3K18ub 增强了 SUV39H1/H2 甲基转移酶活性,并且在结肠癌细胞中,在 DNA 甲基化沉默的抑癌基因 (TSG) 的 CpG 岛启动子处使新的 H3K9me3 结构域成核。破坏 UHRF1 酶活性可防止 H3K9me3 积累,同时促进 PRC2 依赖性 H3K27me3 成为这些区域基因抑制的第三层。相比之下,破坏 H3K18ub 依赖性 SUV39H1/H2 活性增强了 DNMT1 抑制的转录激活和抗增殖作用。总的来说,这些发现揭示了 UHRF1 和 H3K18ub 在调节抑制性组蛋白甲基化信号传导层次结构中的作用,并合理化了表观遗传学癌症治疗的联合策略。
更新日期:2024-12-03
中文翻译:

DNA 低甲基化促进 H3K18ub 和 H3K9me3 之间 UHRF1 和 SUV39H1/H2 依赖性串扰,以增强异染色质状态
由 UHRF1 催化的组蛋白 H3 (H3K18ub) 上赖氨酸 18 的单泛素化是一个 DNMT1 停靠位点,可促进复制偶联 DNA 甲基化维持。除此之外,它的功能尚不清楚。在这里,我们基因组地绘制了 DNMT1 抑制后 UHRF1 依赖性 H3K18ub 和 SUV39H1/H2 依赖性 H3K9me3 同时增加。从机制上讲,半甲基化 DNA 在 CpG 岛的瞬时积累促进了 UHRF1 募集和 E3 连接酶对 H3K18 的活性。值得注意的是,H3K18ub 增强了 SUV39H1/H2 甲基转移酶活性,并且在结肠癌细胞中,在 DNA 甲基化沉默的抑癌基因 (TSG) 的 CpG 岛启动子处使新的 H3K9me3 结构域成核。破坏 UHRF1 酶活性可防止 H3K9me3 积累,同时促进 PRC2 依赖性 H3K27me3 成为这些区域基因抑制的第三层。相比之下,破坏 H3K18ub 依赖性 SUV39H1/H2 活性增强了 DNMT1 抑制的转录激活和抗增殖作用。总的来说,这些发现揭示了 UHRF1 和 H3K18ub 在调节抑制性组蛋白甲基化信号传导层次结构中的作用,并合理化了表观遗传学癌症治疗的联合策略。






























 京公网安备 11010802027423号
京公网安备 11010802027423号