当前位置:
X-MOL 学术
›
Cell Metab.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Personalized phosphoproteomics of skeletal muscle insulin resistance and exercise links MINDY1 to insulin action
Cell Metabolism ( IF 27.7 ) Pub Date : 2024-11-21 , DOI: 10.1016/j.cmet.2024.10.020 Elise J. Needham, Janne R. Hingst, Johan D. Onslev, Alexis Diaz-Vegas, Magnus R. Leandersson, Hannah Huckstep, Jonas M. Kristensen, Kohei Kido, Erik A. Richter, Kurt Højlund, Benjamin L. Parker, Kristen Cooke, Guang Yang, Christian Pehmøller, Sean J. Humphrey, David E. James, Jørgen F.P. Wojtaszewski
Cell Metabolism ( IF 27.7 ) Pub Date : 2024-11-21 , DOI: 10.1016/j.cmet.2024.10.020 Elise J. Needham, Janne R. Hingst, Johan D. Onslev, Alexis Diaz-Vegas, Magnus R. Leandersson, Hannah Huckstep, Jonas M. Kristensen, Kohei Kido, Erik A. Richter, Kurt Højlund, Benjamin L. Parker, Kristen Cooke, Guang Yang, Christian Pehmøller, Sean J. Humphrey, David E. James, Jørgen F.P. Wojtaszewski
|
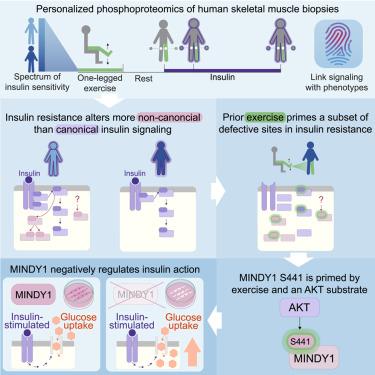
Type 2 diabetes is preceded by a defective insulin response, yet our knowledge of the precise mechanisms is incomplete. Here, we investigate how insulin resistance alters skeletal muscle signaling and how exercise partially counteracts this effect. We measured parallel phenotypes and phosphoproteomes of insulin-resistant (IR) and insulin-sensitive (IS) men as they responded to exercise and insulin (n = 19, 114 biopsies), quantifying over 12,000 phosphopeptides in each biopsy. Insulin resistance involves selective and time-dependent alterations to signaling, including reduced insulin-stimulated mTORC1 and non-canonical signaling responses. Prior exercise promotes insulin sensitivity even in IR individuals by “priming” a portion of insulin signaling prior to insulin infusion. This includes MINDY1 S441, which we show is an AKT substrate. We found that MINDY1 knockdown enhances insulin-stimulated glucose uptake in rat myotubes. This work delineates the signaling alterations in IR skeletal muscle and identifies MINDY1 as a regulator of insulin action.
中文翻译:

骨骼肌胰岛素抵抗和运动的个性化磷酸化蛋白质组学将 MINDY1 与胰岛素作用联系起来
2 型糖尿病之前胰岛素反应有缺陷,但我们对确切机制的了解尚不完整。在这里,我们研究了胰岛素抵抗如何改变骨骼肌信号传导以及运动如何部分抵消这种影响。我们测量了胰岛素抵抗 (IR) 和胰岛素敏感 (IS) 男性对运动和胰岛素反应时的平行表型和磷酸化蛋白质组 (n = 19,114 次活检),量化了每次活检中超过 12,000 种磷酸肽。胰岛素抵抗涉及信号传导的选择性和时间依赖性改变,包括胰岛素刺激的 mTORC1 和非经典信号反应的减少。通过在胰岛素输注前“启动”一部分胰岛素信号传导,先前的运动即使在 IR 个体中也能促进胰岛素敏感性。这包括 MINDY1 S441,我们展示了它是 AKT 底物。我们发现 MINDY1 敲低可增强大鼠肌管中胰岛素刺激的葡萄糖摄取。这项工作描述了 IR 骨骼肌中的信号改变,并确定 MINDY1 是胰岛素作用的调节剂。
更新日期:2024-11-21
中文翻译:

骨骼肌胰岛素抵抗和运动的个性化磷酸化蛋白质组学将 MINDY1 与胰岛素作用联系起来
2 型糖尿病之前胰岛素反应有缺陷,但我们对确切机制的了解尚不完整。在这里,我们研究了胰岛素抵抗如何改变骨骼肌信号传导以及运动如何部分抵消这种影响。我们测量了胰岛素抵抗 (IR) 和胰岛素敏感 (IS) 男性对运动和胰岛素反应时的平行表型和磷酸化蛋白质组 (n = 19,114 次活检),量化了每次活检中超过 12,000 种磷酸肽。胰岛素抵抗涉及信号传导的选择性和时间依赖性改变,包括胰岛素刺激的 mTORC1 和非经典信号反应的减少。通过在胰岛素输注前“启动”一部分胰岛素信号传导,先前的运动即使在 IR 个体中也能促进胰岛素敏感性。这包括 MINDY1 S441,我们展示了它是 AKT 底物。我们发现 MINDY1 敲低可增强大鼠肌管中胰岛素刺激的葡萄糖摄取。这项工作描述了 IR 骨骼肌中的信号改变,并确定 MINDY1 是胰岛素作用的调节剂。






























 京公网安备 11010802027423号
京公网安备 11010802027423号