当前位置:
X-MOL 学术
›
J. Phys. Chem. Lett.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Accelerated Amyloid Aggregation Dynamics of Intrinsically Disordered Proteins in Heavy Water
The Journal of Physical Chemistry Letters ( IF 4.8 ) Pub Date : 2024-11-19 , DOI: 10.1021/acs.jpclett.4c02764 Myung Kook Son, Dongjoon Im, Da Gyeong Hyun, Soohyeong Kim, So Yeon Chun, Jeong-Mo Choi, Tae Su Choi, Minhaeng Cho, Kyungwon Kwak, Hugh I. Kim
The Journal of Physical Chemistry Letters ( IF 4.8 ) Pub Date : 2024-11-19 , DOI: 10.1021/acs.jpclett.4c02764 Myung Kook Son, Dongjoon Im, Da Gyeong Hyun, Soohyeong Kim, So Yeon Chun, Jeong-Mo Choi, Tae Su Choi, Minhaeng Cho, Kyungwon Kwak, Hugh I. Kim
|
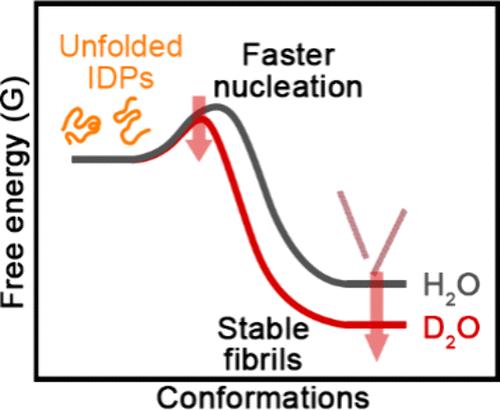
We explored the influence of D2O on the fibrillation kinetics and structural dynamics of amyloid intrinsically disordered proteins (IDPs), including α-synuclein, amyloid-β 1–42, and K18. Our findings revealed that fibrillation of IDPs was accelerated in D2O compared to that in H2O, exhibiting faster kinetics in contrast to the structured protein, insulin. Structural investigations using electrospray ionization ion mobility mass spectrometry and small-angle X-ray scattering combined with molecular dynamics simulations demonstrated that IDPs did not show significant structural changes that could influence accelerated fibrillation in D2O. Umbrella sampling of protein protofibrils verified that an increased level of hydrogen bonding of D2O and enhanced hydrophobic interactions stabilized β-sheet structured fibrils in D2O. These findings indicate that stabilizing β-sheet fibrils and a more hydrophobic microenvironment in D2O result in enhanced and faster fibrillation of IDPs. The study highlights the importance of considering D2O’s differential impact on protein interactions when conducting structural and kinetic analyses, particularly for native peptides and proteins.
中文翻译:

重水中内在无序蛋白的加速淀粉样蛋白聚集动力学
我们探讨了 D2O 对淀粉样蛋白固有无序蛋白 (IDP) 的纤颤动力学和结构动力学的影响,包括 α-突触核蛋白、淀粉样蛋白-β 1-42 和 K18。我们的研究结果表明,与 H2O 相比,D2O 中 IDPs 的纤颤加速,与结构蛋白胰岛素相比,表现出更快的动力学。使用电喷雾电离离子迁移质谱和小角 X 射线散射结合分子动力学模拟的结构研究表明,IDP 没有表现出可能影响 D2O 加速纤颤的显着结构变化。蛋白质原纤维的伞式采样证实,D2O 氢键水平的增加和疏水相互作用的增强稳定了 D 2 中的 β 片状结构原纤维O.这些发现表明,稳定的 β 片原纤维和 D2O 中更疏水的微环境导致 IDP 的原纤化增强和更快。该研究强调了在进行结构和动力学分析时考虑 D2O 对蛋白质相互作用的不同影响的重要性,特别是对于天然肽和蛋白质。
更新日期:2024-11-19
中文翻译:

重水中内在无序蛋白的加速淀粉样蛋白聚集动力学
我们探讨了 D2O 对淀粉样蛋白固有无序蛋白 (IDP) 的纤颤动力学和结构动力学的影响,包括 α-突触核蛋白、淀粉样蛋白-β 1-42 和 K18。我们的研究结果表明,与 H2O 相比,D2O 中 IDPs 的纤颤加速,与结构蛋白胰岛素相比,表现出更快的动力学。使用电喷雾电离离子迁移质谱和小角 X 射线散射结合分子动力学模拟的结构研究表明,IDP 没有表现出可能影响 D2O 加速纤颤的显着结构变化。蛋白质原纤维的伞式采样证实,D2O 氢键水平的增加和疏水相互作用的增强稳定了 D 2 中的 β 片状结构原纤维O.这些发现表明,稳定的 β 片原纤维和 D2O 中更疏水的微环境导致 IDP 的原纤化增强和更快。该研究强调了在进行结构和动力学分析时考虑 D2O 对蛋白质相互作用的不同影响的重要性,特别是对于天然肽和蛋白质。

































 京公网安备 11010802027423号
京公网安备 11010802027423号