Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Fibroblastic reticular cells generate protective intratumoral T cell environments in lung cancer
Cell ( IF 45.5 ) Pub Date : 2024-11-19 , DOI: 10.1016/j.cell.2024.10.042 Lucas Onder, Chrysa Papadopoulou, Almut Lütge, Hung-Wei Cheng, Mechthild Lütge, Christian Perez-Shibayama, Cristina Gil-Cruz, Angelina De Martin, Lisa Kurz, Nadine Cadosch, Natalia B. Pikor, Regulo Rodriguez, Diana Born, Wolfram Jochum, Pawel Leskow, Andre Dutly, Mark D. Robinson, Burkhard Ludewig
Cell ( IF 45.5 ) Pub Date : 2024-11-19 , DOI: 10.1016/j.cell.2024.10.042 Lucas Onder, Chrysa Papadopoulou, Almut Lütge, Hung-Wei Cheng, Mechthild Lütge, Christian Perez-Shibayama, Cristina Gil-Cruz, Angelina De Martin, Lisa Kurz, Nadine Cadosch, Natalia B. Pikor, Regulo Rodriguez, Diana Born, Wolfram Jochum, Pawel Leskow, Andre Dutly, Mark D. Robinson, Burkhard Ludewig
|
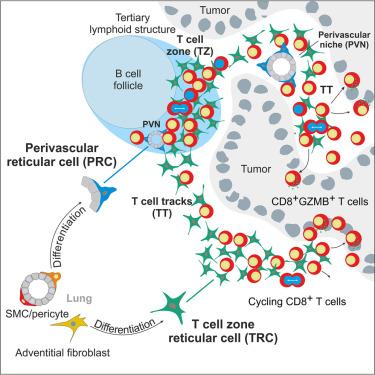
Stringent control of T cell activity in the tumor microenvironment is essential for the generation of protective antitumor immunity. However, the identity, differentiation, and functions of the cells that create critical fibroblastic niches promoting tumor-infiltrating T cells remain elusive. Here, we show that CCL19-expressing fibroblastic reticular cells (FRCs) generate interconnected T cell environments (TEs) in human non-small cell lung cancer, including tertiary lymphoid structures and T cell tracks. Analysis of the FRC-T cell interactome in TEs indicated molecular networks regulating niche-specific differentiation of CCL19-expressing fibroblasts and T cell activation pathways. Single-cell transcriptomics and cell fate-mapping analyses in mice confirmed that FRCs in TEs originate from mural and adventitial progenitors. Ablation of intratumoral FRC precursors decreased antitumor T cell activity, resulting in reduced tumor control during coronavirus vector-based immunotherapy. In summary, specialized FRC niches in the tumor microenvironment govern the quality and extent of antitumor T cell immunity.
中文翻译:

成纤维细胞网状细胞在肺癌中产生保护性瘤内 T 细胞环境
严格控制肿瘤微环境中的 T 细胞活性对于产生保护性抗肿瘤免疫至关重要。然而,产生促进肿瘤浸润 T 细胞的关键成纤维细胞生态位的细胞的身份、分化和功能仍然难以捉摸。在这里,我们表明表达 CCL19 的成纤维细胞网状细胞 (FRC) 在人类非小细胞肺癌中产生互连的 T 细胞环境 (TE),包括三级淋巴结构和 T 细胞轨迹。对 TE 中 FRC-T 细胞相互作用组的分析表明,分子网络调节表达 CCL19 的成纤维细胞和 T 细胞活化途径的生态位特异性分化。小鼠的单细胞转录组学和细胞命运图谱分析证实,TE 中的 FRCs 起源于壁画和外源祖细胞。瘤内 FRC 前体消融降低了抗肿瘤 T 细胞活性,导致基于冠状病毒载体的免疫治疗期间肿瘤控制减少。总之,肿瘤微环境中的特殊 FRC 生态位控制着抗肿瘤 T 细胞免疫的质量和程度。
更新日期:2024-11-20
中文翻译:

成纤维细胞网状细胞在肺癌中产生保护性瘤内 T 细胞环境
严格控制肿瘤微环境中的 T 细胞活性对于产生保护性抗肿瘤免疫至关重要。然而,产生促进肿瘤浸润 T 细胞的关键成纤维细胞生态位的细胞的身份、分化和功能仍然难以捉摸。在这里,我们表明表达 CCL19 的成纤维细胞网状细胞 (FRC) 在人类非小细胞肺癌中产生互连的 T 细胞环境 (TE),包括三级淋巴结构和 T 细胞轨迹。对 TE 中 FRC-T 细胞相互作用组的分析表明,分子网络调节表达 CCL19 的成纤维细胞和 T 细胞活化途径的生态位特异性分化。小鼠的单细胞转录组学和细胞命运图谱分析证实,TE 中的 FRCs 起源于壁画和外源祖细胞。瘤内 FRC 前体消融降低了抗肿瘤 T 细胞活性,导致基于冠状病毒载体的免疫治疗期间肿瘤控制减少。总之,肿瘤微环境中的特殊 FRC 生态位控制着抗肿瘤 T 细胞免疫的质量和程度。






























 京公网安备 11010802027423号
京公网安备 11010802027423号