当前位置:
X-MOL 学术
›
ACS Catal.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Reversing the Enantioselectivity of Enzymatic Dynamic Kinetic Asymmetric Transformations in the Synthesis of Fused Lactones
ACS Catalysis ( IF 11.3 ) Pub Date : 2024-11-12 , DOI: 10.1021/acscatal.4c05196 Mingliang Shi, Yao Yao, Xinyue Fan, Kun Li, Xiaoqi Yu, Yan Liu, Zhongliu Wu, Na Wang
ACS Catalysis ( IF 11.3 ) Pub Date : 2024-11-12 , DOI: 10.1021/acscatal.4c05196 Mingliang Shi, Yao Yao, Xinyue Fan, Kun Li, Xiaoqi Yu, Yan Liu, Zhongliu Wu, Na Wang
|
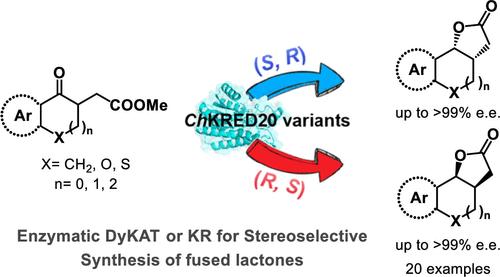
The rational design of one ketoreductase into stereocomplementary variants for controlling the stereoselectivity of bulky chiral molecules bearing contiguous stereocenters is highly desirable and challenging. Herein, we report protein engineering of ketoreductase from Chryseobacterium sp. CA49 (ChKRED20) through targeted mutagenesis of only two key residues (Y188 and H145) located in the enzyme pocket, achieving the precise stereocontrol over the synthesis of tricyclic fused lactones (highest reversing enantioselectivity from >99:1 e.r. to <1:99 e.r.). Notably, both kinetic resolution asymmetric reduction (KR-AR) and dynamic kinetic asymmetric transformation (DyKAT) were observed in this system. In the KR-AR process, ChKRED20 variants exclusively convert (R)- or (S)-keto esters to corresponding enantio- and diastereoenriched (R,S)- or (S,R)-cis-lactones and deliver leftover (S)- or (R)-keto esters. On the contrary, in the DyKAT process, unreactive configurations of substrates undergo efficient equilibration via an enolization through protonation–deprotonation in enzymes. Computational studies are also conducted to get insight into the origin of stereoselectivity and enantioselectivity.
中文翻译:

逆转熔融内酯合成中酶动力学不对称转化的对映选择性
将一种酮还原酶合理设计成立体互补变体,以控制带有连续立体中心的大体积手性分子的立体选择性是非常可取和具有挑战性的。在此,我们报道了来自黄杆菌属 CA49 (ChKRED20) 的酮还原酶的蛋白质工程,通过仅靶向诱变位于酶袋中的两个关键残基 (Y188 和 H145),实现了对三环稠融内酯合成的精确立体控制(最高反向对映选择性从 >99:1 er.r. 到 <1:99 e.r.)。值得注意的是,在该系统中观察到动力学分辨率不对称还原 (KR-AR) 和动态动力学不对称变换 (DyKAT)。在 KR-AR 工艺中,ChKRED20 变体专门将 (R) 或 (S)-酮酯转化为相应的对映体和非对映富集 (R,S) 或 (S,R)-顺式内酯,并输送剩余的 (S) 或 (R) 酮酯。相反,在 DyKAT 工艺中,底物的未反应构型通过酶中的质子化-去质子化的烯醇化进行有效平衡。还进行了计算研究以深入了解立体选择性和对映选择性的起源。
更新日期:2024-11-13
中文翻译:

逆转熔融内酯合成中酶动力学不对称转化的对映选择性
将一种酮还原酶合理设计成立体互补变体,以控制带有连续立体中心的大体积手性分子的立体选择性是非常可取和具有挑战性的。在此,我们报道了来自黄杆菌属 CA49 (ChKRED20) 的酮还原酶的蛋白质工程,通过仅靶向诱变位于酶袋中的两个关键残基 (Y188 和 H145),实现了对三环稠融内酯合成的精确立体控制(最高反向对映选择性从 >99:1 er.r. 到 <1:99 e.r.)。值得注意的是,在该系统中观察到动力学分辨率不对称还原 (KR-AR) 和动态动力学不对称变换 (DyKAT)。在 KR-AR 工艺中,ChKRED20 变体专门将 (R) 或 (S)-酮酯转化为相应的对映体和非对映富集 (R,S) 或 (S,R)-顺式内酯,并输送剩余的 (S) 或 (R) 酮酯。相反,在 DyKAT 工艺中,底物的未反应构型通过酶中的质子化-去质子化的烯醇化进行有效平衡。还进行了计算研究以深入了解立体选择性和对映选择性的起源。




















































 京公网安备 11010802027423号
京公网安备 11010802027423号