当前位置:
X-MOL 学术
›
Cell Stem Cell
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Post-transplant G-CSF impedes engraftment of gene-edited human hematopoietic stem cells by exacerbating p53-mediated DNA damage response
Cell Stem Cell ( IF 19.8 ) Pub Date : 2024-11-12 , DOI: 10.1016/j.stem.2024.10.013 Daisuke Araki, Vicky Chen, Neelam Redekar, Christi Salisbury-Ruf, Yan Luo, Poching Liu, Yuesheng Li, Richard H. Smith, Pradeep Dagur, Christian Combs, Andre Larochelle
Cell Stem Cell ( IF 19.8 ) Pub Date : 2024-11-12 , DOI: 10.1016/j.stem.2024.10.013 Daisuke Araki, Vicky Chen, Neelam Redekar, Christi Salisbury-Ruf, Yan Luo, Poching Liu, Yuesheng Li, Richard H. Smith, Pradeep Dagur, Christian Combs, Andre Larochelle
|
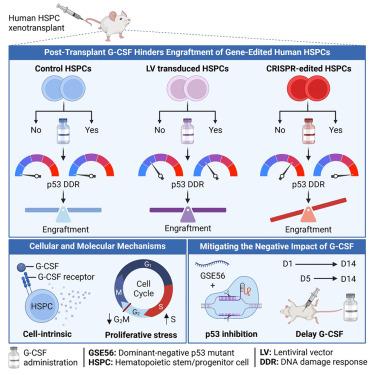
Granulocyte-colony-stimulating factor (G-CSF) is commonly used to accelerate recovery from neutropenia following chemotherapy and autologous transplantation of hematopoietic stem and progenitor cells (HSPCs) for malignant disorders. However, its utility after ex vivo gene therapy in human HSPCs remains unexplored. We show that administering G-CSF from day 1 to 14 post-transplant impedes engraftment of CRISPR-Cas9 gene-edited human HSPCs in murine xenograft models. G-CSF affects gene-edited HSPCs through a cell-intrinsic mechanism, causing proliferative stress and amplifying the early p53-mediated DNA damage response triggered by Cas9-mediated DNA double-strand breaks. This underscores a threshold mechanism where p53 activation must reach a critical level to impair cellular function. Transiently inhibiting p53 or delaying the initiation of G-CSF treatment to day 5 post-transplant attenuates its negative impact on gene-edited HSPCs. The potential for increased HSPC toxicity associated with post-transplant G-CSF administration in CRISPR-Cas9 autologous HSPC gene therapy warrants consideration in clinical trials.
中文翻译:

移植后 G-CSF 通过加剧 p53 介导的 DNA 损伤反应来阻碍基因编辑的人造血干细胞的植入
粒细胞集落刺激因子 (G-CSF) 通常用于加速恶性疾病化疗和造血干细胞和祖细胞 (HSPC) 自体移植后中性粒细胞减少症的恢复。然而,它在人类 HSPC 中离 体基因治疗后的效用仍未得到探索。我们表明,从移植后第 1 天到第 14 天施用 G-CSF 会阻碍 CRISPR-Cas9 基因编辑的人 HSPC 在小鼠异种移植模型中的植入。G-CSF 通过细胞内在机制影响基因编辑的 HSPC,引起增殖应激并放大由 Cas9 介导的 DNA 双链断裂触发的早期 p53 介导的 DNA 损伤反应。这强调了 p53 激活必须达到临界水平才能损害细胞功能的阈值机制。瞬时抑制 p53 或将 G-CSF 治疗的开始推迟到移植后第 5 天,可减轻其对基因编辑 HSPC 的负面影响。在 CRISPR-Cas9 自体 HSPC 基因治疗中,移植后 G-CSF 给药可能增加 HSPC 毒性,值得在临床试验中考虑。
更新日期:2024-11-12
中文翻译:

移植后 G-CSF 通过加剧 p53 介导的 DNA 损伤反应来阻碍基因编辑的人造血干细胞的植入
粒细胞集落刺激因子 (G-CSF) 通常用于加速恶性疾病化疗和造血干细胞和祖细胞 (HSPC) 自体移植后中性粒细胞减少症的恢复。然而,它在人类 HSPC 中离 体基因治疗后的效用仍未得到探索。我们表明,从移植后第 1 天到第 14 天施用 G-CSF 会阻碍 CRISPR-Cas9 基因编辑的人 HSPC 在小鼠异种移植模型中的植入。G-CSF 通过细胞内在机制影响基因编辑的 HSPC,引起增殖应激并放大由 Cas9 介导的 DNA 双链断裂触发的早期 p53 介导的 DNA 损伤反应。这强调了 p53 激活必须达到临界水平才能损害细胞功能的阈值机制。瞬时抑制 p53 或将 G-CSF 治疗的开始推迟到移植后第 5 天,可减轻其对基因编辑 HSPC 的负面影响。在 CRISPR-Cas9 自体 HSPC 基因治疗中,移植后 G-CSF 给药可能增加 HSPC 毒性,值得在临床试验中考虑。




















































 京公网安备 11010802027423号
京公网安备 11010802027423号