Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
A glycosylated AIE-active Fe(III) photosensitizer activated by the tumor microenvironment for synergistic type I photodynamic and chemodynamic therapy
Nanoscale ( IF 5.8 ) Pub Date : 2024-11-06 , DOI: 10.1039/d4nr03871a Gai-Li Feng, Wei Zhou, Jin-ping Qiao, Guang-Jian Liu, Guo-Wen Xing
Nanoscale ( IF 5.8 ) Pub Date : 2024-11-06 , DOI: 10.1039/d4nr03871a Gai-Li Feng, Wei Zhou, Jin-ping Qiao, Guang-Jian Liu, Guo-Wen Xing
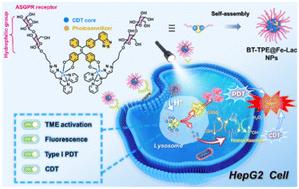
|
Photodynamic therapy (PDT) and chemodynamic therapy (CDT) are both promising cancer treatments to inhibit tumor cells by generating highly cytotoxic reactive oxygen species (ROS). Herein, we report a novel tumor microenvironment (TME) stimulus-responsive water-soluble glycosylated photosensitizer (BT-TPE@Fe-Lac), which can serve as a high-efficiency antitumor agent by combining PDT and CDT, based on the coordination of Fe3+ with lactosyl bis(2-pyridylmethyl)amine and an AIE luminogen (benzothiazole-hydroxytetraphenylethene, BT-TPE). BT-TPE@Fe-Lac is stable under physiological conditions and selectively targets HepG2 cells via asialoglycoprotein receptor (ASGPR)-mediated endocytosis. It rapidly dissociates into AIE-active BT-TPE molecules and a lactosyl ferric(III) complex in the acidic lysosomes of cancer cells. Upon exposure to light, BT-TPE produces O2˙− radicals for type I PDT. The ferric(III) complex is reduced to an Fe(II) complex upon depletion of glutathione, which primes the breakdown of endogenous H2O2 within the tumor microenvironment, thus generating highly toxic ˙OH for enhanced CDT. Compared with the monotherapy of PDT or CDT, BT-TPE@Fe-Lac can significantly increase the intracellular ROS levels to induce more tumor cell death under low drug doses and hypoxia-dependent conditions. This strategy leverages the unique properties of the TME to optimize therapeutic outcomes, offering a promising approach for the TME-responsive nanoplatform in advanced cancer therapy.
中文翻译:

一种由肿瘤微环境激活的糖基化 AIE 活性 Fe(III) 光敏剂,用于协同 I 型光动力和化学动力学治疗
光动力疗法 (PDT) 和化学动力学疗法 (CDT) 都是很有前途的癌症治疗方法,通过产生高度细胞毒性活性氧 (ROS) 来抑制肿瘤细胞。在此,我们报道了一种新型肿瘤微环境 (TME) 刺激反应性水溶性糖基化光敏剂 (BT-TPE@Fe-Lac),它可以通过结合 PDT 和 CDT 作为高效抗肿瘤剂,基于 Fe3+ 与乳糖基双(2-吡啶甲基)胺和 AIE 发光物(苯并噻唑-羟基四苯乙烯,BT-TPE)。BT-TPE@Fe-Lac 在生理条件下稳定,并通过唾液酸糖蛋白受体 (ASGPR) 介导的内吞作用选择性靶向 HepG2 细胞。它在癌细胞的酸性溶酶体中迅速解离成具有 AIE 活性的 BT-TPE 分子和乳糖基铁 (III) 复合物。在光照下,BT-TPE 会产生 I 型 PDT 的 O2 ̇− 自由基。铁 (III) 配合物在谷胱甘肽耗竭后被还原为 Fe(II) 配合物,从而引发肿瘤微环境中内源性 H2O2 的分解,从而产生剧毒的 ̇OH 以增强 CDT。与 PDT 或 CDT 的单一疗法相比,BT-TPE@Fe-Lac 在低药物剂量和缺氧依赖性条件下可显着增加细胞内 ROS 水平,诱导更多的肿瘤细胞死亡。该策略利用 TME 的独特特性来优化治疗结果,为晚期癌症治疗中的 TME 响应纳米平台提供了一种有前途的方法。
更新日期:2024-11-06
中文翻译:

一种由肿瘤微环境激活的糖基化 AIE 活性 Fe(III) 光敏剂,用于协同 I 型光动力和化学动力学治疗
光动力疗法 (PDT) 和化学动力学疗法 (CDT) 都是很有前途的癌症治疗方法,通过产生高度细胞毒性活性氧 (ROS) 来抑制肿瘤细胞。在此,我们报道了一种新型肿瘤微环境 (TME) 刺激反应性水溶性糖基化光敏剂 (BT-TPE@Fe-Lac),它可以通过结合 PDT 和 CDT 作为高效抗肿瘤剂,基于 Fe3+ 与乳糖基双(2-吡啶甲基)胺和 AIE 发光物(苯并噻唑-羟基四苯乙烯,BT-TPE)。BT-TPE@Fe-Lac 在生理条件下稳定,并通过唾液酸糖蛋白受体 (ASGPR) 介导的内吞作用选择性靶向 HepG2 细胞。它在癌细胞的酸性溶酶体中迅速解离成具有 AIE 活性的 BT-TPE 分子和乳糖基铁 (III) 复合物。在光照下,BT-TPE 会产生 I 型 PDT 的 O2 ̇− 自由基。铁 (III) 配合物在谷胱甘肽耗竭后被还原为 Fe(II) 配合物,从而引发肿瘤微环境中内源性 H2O2 的分解,从而产生剧毒的 ̇OH 以增强 CDT。与 PDT 或 CDT 的单一疗法相比,BT-TPE@Fe-Lac 在低药物剂量和缺氧依赖性条件下可显着增加细胞内 ROS 水平,诱导更多的肿瘤细胞死亡。该策略利用 TME 的独特特性来优化治疗结果,为晚期癌症治疗中的 TME 响应纳米平台提供了一种有前途的方法。


















































 京公网安备 11010802027423号
京公网安备 11010802027423号