Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
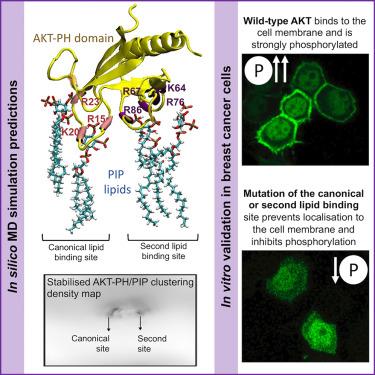
Two cooperative lipid binding sites within the pleckstrin homology domain are necessary for AKT binding and stabilization to the plasma membrane
Structure ( IF 4.4 ) Pub Date : 2024-11-05 , DOI: 10.1016/j.str.2024.10.020 Chrysa Soteriou, Mengfan Xu, Simon D. Connell, Arwen I.I. Tyler, Antreas C. Kalli, James L. Thorne
Structure ( IF 4.4 ) Pub Date : 2024-11-05 , DOI: 10.1016/j.str.2024.10.020 Chrysa Soteriou, Mengfan Xu, Simon D. Connell, Arwen I.I. Tyler, Antreas C. Kalli, James L. Thorne
|
Almost four decades after the identification of the AKT protein and understanding of its role in cancer, barriers remain in the translation of AKT inhibitors for clinical applications. Here, we provide new molecular insight into the first step of AKT activation where AKT binds to the plasma membrane and its orientation is stabilized in a bilayer with lateral heterogeneity (Lo-Ld phase coexistence). We have applied molecular dynamic simulations and molecular and cell biology approaches, and demonstrate that AKT recruitment to the membrane requires a second binding site in the AKT pleckstrin homology (PH) domain that acts cooperatively with the known canonical binding site. Given the precision with which we have identified the protein-lipid interactions, the study offers new directions for AKT-targeted therapy and for testing small molecules to target these specific amino acid-PIP molecular bonds.
中文翻译:

pleckstrin 同源结构域内的两个协同脂质结合位点对于 AKT 与质膜的结合和稳定是必需的
在鉴定 AKT 蛋白并了解其在癌症中的作用近四十年后,AKT 抑制剂在临床应用中的转化仍然存在障碍。在这里,我们为 AKT 激活的第一步提供了新的分子见解,其中 AKT 与质膜结合,其方向稳定在具有横向异质性 (Lo-L d 期共存) 的双层中。我们应用了分子动力学模拟以及分子和细胞生物学方法,并证明 AKT 募集到膜需要在 AKT 普列克底物蛋白同源 (PH) 结构域中的第二个结合位点与已知的经典结合位点协同作用。鉴于我们鉴定蛋白质-脂质相互作用的精度,该研究为 AKT 靶向治疗和测试靶向这些特定氨基酸-PIP 分子键的小分子提供了新的方向。
更新日期:2024-11-05
中文翻译:

pleckstrin 同源结构域内的两个协同脂质结合位点对于 AKT 与质膜的结合和稳定是必需的
在鉴定 AKT 蛋白并了解其在癌症中的作用近四十年后,AKT 抑制剂在临床应用中的转化仍然存在障碍。在这里,我们为 AKT 激活的第一步提供了新的分子见解,其中 AKT 与质膜结合,其方向稳定在具有横向异质性 (Lo-L d 期共存) 的双层中。我们应用了分子动力学模拟以及分子和细胞生物学方法,并证明 AKT 募集到膜需要在 AKT 普列克底物蛋白同源 (PH) 结构域中的第二个结合位点与已知的经典结合位点协同作用。鉴于我们鉴定蛋白质-脂质相互作用的精度,该研究为 AKT 靶向治疗和测试靶向这些特定氨基酸-PIP 分子键的小分子提供了新的方向。






























 京公网安备 11010802027423号
京公网安备 11010802027423号