当前位置:
X-MOL 学术
›
Cell Stem Cell
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Microglia depletion reduces human neuronal APOE4-related pathologies in a chimeric Alzheimer’s disease model
Cell Stem Cell ( IF 19.8 ) Pub Date : 2024-11-04 , DOI: 10.1016/j.stem.2024.10.005 Antara Rao, Nuo Chen, Min Joo Kim, Jessica Blumenfeld, Oscar Yip, Zherui Liang, David Shostak, Yanxia Hao, Maxine R. Nelson, Nicole Koutsodendris, Brian Grone, Leo Ding, Seo Yeon Yoon, Patrick Arriola, Misha Zilberter, Yadong Huang
Cell Stem Cell ( IF 19.8 ) Pub Date : 2024-11-04 , DOI: 10.1016/j.stem.2024.10.005 Antara Rao, Nuo Chen, Min Joo Kim, Jessica Blumenfeld, Oscar Yip, Zherui Liang, David Shostak, Yanxia Hao, Maxine R. Nelson, Nicole Koutsodendris, Brian Grone, Leo Ding, Seo Yeon Yoon, Patrick Arriola, Misha Zilberter, Yadong Huang
|
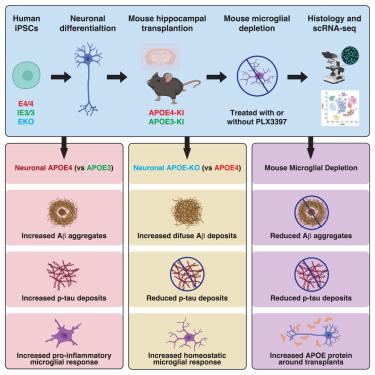
Despite strong evidence supporting the important roles of both apolipoprotein E4 (APOE4) and microglia in Alzheimer’s disease (AD) pathogenesis, the effects of microglia on neuronal APOE4-related AD pathogenesis remain elusive. To examine such effects, we utilized microglial depletion in a chimeric model with induced pluripotent stem cell (iPSC)-derived human neurons in mouse hippocampus. Specifically, we transplanted homozygous APOE4, isogenic APOE3, and APOE-knockout (APOE-KO) iPSC-derived human neurons into the hippocampus of human APOE3 or APOE4 knockin mice and then depleted microglia in half of the chimeric mice. We found that both neuronal APOE and microglial presence were important for the formation of Aβ and tau pathologies in an APOE isoform-dependent manner (APOE4 > APOE3). Single-cell RNA sequencing analysis identified two pro-inflammatory microglial subtypes with elevated MHC-II gene expression enriched in chimeric mice with human APOE4 neuron transplants. These findings highlight the concerted roles of neuronal APOE, especially APOE4, and microglia in AD pathogenesis.
中文翻译:

小胶质细胞耗竭减少了嵌合阿尔茨海默病模型中人类神经元 APOE4 相关病理
尽管有强有力的证据支持载脂蛋白 E4 (APOE4) 和小胶质细胞在阿尔茨海默病 (AD) 发病机制中的重要作用,但小胶质细胞对神经元 APOE4 相关 AD 发病机制的影响仍然难以捉摸。为了检查这种影响,我们在小鼠海马体中具有诱导多能干细胞 (iPSC) 衍生的人类神经元的嵌合模型中利用了小胶质细胞耗竭。具体来说,我们将纯合子 APOE4 、同基因 APOE3 和 APOE 敲除 (APOE-KO) iPSC 衍生的人神经元移植到人 APOE3 或 APOE4 敲入小鼠的海马体中,然后在一半的嵌合小鼠中耗尽小胶质细胞。我们发现神经元 APOE 和小胶质细胞的存在对于 APOE 亚型依赖性方式 (APOE4 > APOE3) 的 Aβ 和 tau 病理的形成很重要。单细胞 RNA 测序分析确定了两种促炎性小胶质细胞亚型,在人 APOE4 神经元移植的嵌合小鼠中富含 MHC-II 基因表达。这些发现突出了神经元 APOE(尤其是 APOE4)和小胶质细胞在 AD 发病机制中的协同作用。
更新日期:2024-11-04
中文翻译:

小胶质细胞耗竭减少了嵌合阿尔茨海默病模型中人类神经元 APOE4 相关病理
尽管有强有力的证据支持载脂蛋白 E4 (APOE4) 和小胶质细胞在阿尔茨海默病 (AD) 发病机制中的重要作用,但小胶质细胞对神经元 APOE4 相关 AD 发病机制的影响仍然难以捉摸。为了检查这种影响,我们在小鼠海马体中具有诱导多能干细胞 (iPSC) 衍生的人类神经元的嵌合模型中利用了小胶质细胞耗竭。具体来说,我们将纯合子 APOE4 、同基因 APOE3 和 APOE 敲除 (APOE-KO) iPSC 衍生的人神经元移植到人 APOE3 或 APOE4 敲入小鼠的海马体中,然后在一半的嵌合小鼠中耗尽小胶质细胞。我们发现神经元 APOE 和小胶质细胞的存在对于 APOE 亚型依赖性方式 (APOE4 > APOE3) 的 Aβ 和 tau 病理的形成很重要。单细胞 RNA 测序分析确定了两种促炎性小胶质细胞亚型,在人 APOE4 神经元移植的嵌合小鼠中富含 MHC-II 基因表达。这些发现突出了神经元 APOE(尤其是 APOE4)和小胶质细胞在 AD 发病机制中的协同作用。































 京公网安备 11010802027423号
京公网安备 11010802027423号