当前位置:
X-MOL 学术
›
Eur. J. Med. Chem.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Discovery of the first selective and potent PROTAC degrader for the pseudokinase TRIB2
European Journal of Medicinal Chemistry ( IF 6.0 ) Pub Date : 2024-11-01 , DOI: 10.1016/j.ejmech.2024.117016 Chaowei Wen, Prathibha R. Gajjala, Yihan Liu, Bingzhong Chen, Mehtab S. Bal, Payal Sutaria, Qiao Yuanyuan, Yang Zheng, Yang Zhou, Jinwei Zhang, Weixue Huang, Xiaomei Ren, Zhen Wang, Ke Ding, Arul M. Chinnaiyan, Fengtao Zhou
European Journal of Medicinal Chemistry ( IF 6.0 ) Pub Date : 2024-11-01 , DOI: 10.1016/j.ejmech.2024.117016 Chaowei Wen, Prathibha R. Gajjala, Yihan Liu, Bingzhong Chen, Mehtab S. Bal, Payal Sutaria, Qiao Yuanyuan, Yang Zheng, Yang Zhou, Jinwei Zhang, Weixue Huang, Xiaomei Ren, Zhen Wang, Ke Ding, Arul M. Chinnaiyan, Fengtao Zhou
|
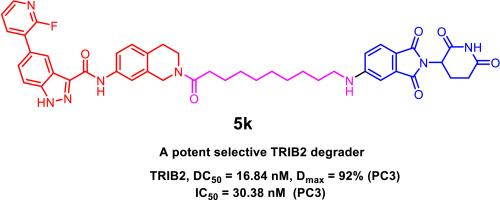
Pseudokinase TRIB2, a member of the CAMK Ser/Thr protein kinase family, regulates various cellular processes through phosphorylation-independent mechanisms. Dysregulation of TRIB2 has been implicated in promoting tumor growth, metastasis, and therapy resistance, making it a promising target for cancer treatment. In this study, we designed and synthesized a series of TRIB2 PROTAC degraders by conjugating a TRIB2 binder 1 with VHL or CRBN ligands via linkers of varying lengths and compositions. Among these compounds, 5k demonstrated potent TRIB2 degradation with a DC50 value of 16.84 nM (95 % CI: 13.66–20.64 nM) in prostate cancer PC3 cells. Mechanistic studies revealed that 5k directly interacted with TRIB2, selectively inducing its degradation through a CRBN-dependent ubiquitin-proteasomal pathway. Moreover, 5k outperformed the TRIB2 binder alone in inhibiting cell proliferation and inducing apoptosis, confirming that TRIB2 protein degradation could be a promising therapeutic strategy for TRIB2-associated cancers. Additionally, compound 5k also serves as an effective tool for probing TRIB2 biology.
中文翻译:

发现第一个针对假激酶 TRIB2 的选择性和强效 PROTAC 降解剂
假激酶 TRIB2 是 CAMK 丝氨酸/苏氨酸蛋白激酶家族的一员,通过磷酸化非依赖性机制调节各种细胞过程。TRIB2 的失调与促进肿瘤生长、转移和治疗耐药有关,使其成为癌症治疗的有前途的靶点。在这项研究中,我们通过不同长度和组成的接头将 TRIB2 结合剂 1 与 VHL 或 CRBN 配体偶联,设计并合成了一系列 TRIB2 PROTAC 降解剂。在这些化合物中,5k 在前列腺癌 PC3 细胞中表现出有效的 TRIB2 降解,DC50 值为 16.84 nM(95 % CI:13.66–20.64 nM)。机制研究表明,5k 直接与 TRIB2 相互作用,通过 CRBN 依赖性泛素-蛋白酶体途径选择性诱导其降解。此外,5k 在抑制细胞增殖和诱导细胞凋亡方面优于单独的 TRIB2 结合剂,证实 TRIB2 蛋白降解可能是 TRIB2 相关癌症的一种有前途的治疗策略。此外,化合物 5k 也可作为探测 TRIB2 生物学的有效工具。
更新日期:2024-11-01
中文翻译:

发现第一个针对假激酶 TRIB2 的选择性和强效 PROTAC 降解剂
假激酶 TRIB2 是 CAMK 丝氨酸/苏氨酸蛋白激酶家族的一员,通过磷酸化非依赖性机制调节各种细胞过程。TRIB2 的失调与促进肿瘤生长、转移和治疗耐药有关,使其成为癌症治疗的有前途的靶点。在这项研究中,我们通过不同长度和组成的接头将 TRIB2 结合剂 1 与 VHL 或 CRBN 配体偶联,设计并合成了一系列 TRIB2 PROTAC 降解剂。在这些化合物中,5k 在前列腺癌 PC3 细胞中表现出有效的 TRIB2 降解,DC50 值为 16.84 nM(95 % CI:13.66–20.64 nM)。机制研究表明,5k 直接与 TRIB2 相互作用,通过 CRBN 依赖性泛素-蛋白酶体途径选择性诱导其降解。此外,5k 在抑制细胞增殖和诱导细胞凋亡方面优于单独的 TRIB2 结合剂,证实 TRIB2 蛋白降解可能是 TRIB2 相关癌症的一种有前途的治疗策略。此外,化合物 5k 也可作为探测 TRIB2 生物学的有效工具。


















































 京公网安备 11010802027423号
京公网安备 11010802027423号