当前位置:
X-MOL 学术
›
Cell Host Microbe
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Exclusive enteral nutrition initiates individual protective microbiome changes to induce remission in pediatric Crohn’s disease
Cell Host & Microbe ( IF 20.6 ) Pub Date : 2024-10-25 , DOI: 10.1016/j.chom.2024.10.001 Deborah Häcker, Kolja Siebert, Byron J. Smith, Nikolai Köhler, Alessandra Riva, Aritra Mahapatra, Helena Heimes, Jiatong Nie, Amira Metwaly, Hannes Hölz, Quirin Manz, Federica De Zen, Jeannine Heetmeyer, Katharina Socas, Giang Le Thi, Chen Meng, Karin Kleigrewe, Josch K. Pauling, Klaus Neuhaus, Markus List, Dirk Haller
Cell Host & Microbe ( IF 20.6 ) Pub Date : 2024-10-25 , DOI: 10.1016/j.chom.2024.10.001 Deborah Häcker, Kolja Siebert, Byron J. Smith, Nikolai Köhler, Alessandra Riva, Aritra Mahapatra, Helena Heimes, Jiatong Nie, Amira Metwaly, Hannes Hölz, Quirin Manz, Federica De Zen, Jeannine Heetmeyer, Katharina Socas, Giang Le Thi, Chen Meng, Karin Kleigrewe, Josch K. Pauling, Klaus Neuhaus, Markus List, Dirk Haller
|
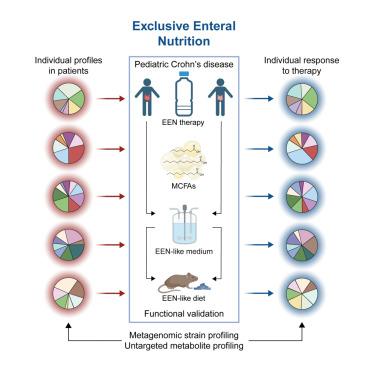
Exclusive enteral nutrition (EEN) is a first-line therapy for pediatric Crohn’s disease (CD), but protective mechanisms remain unknown. We established a prospective pediatric cohort to characterize the function of fecal microbiota and metabolite changes of treatment-naive CD patients in response to EEN (German Clinical Trials DRKS00013306). Integrated multi-omics analysis identified network clusters from individually variable microbiome profiles, with Lachnospiraceae and medium-chain fatty acids as protective features. Bioorthogonal non-canonical amino acid tagging selectively identified bacterial species in response to medium-chain fatty acids. Metagenomic analysis identified high strain-level dynamics in response to EEN. Functional changes in diet-exposed fecal microbiota were further validated using gut chemostat cultures and microbiota transfer into germ-free Il10-deficient mice. Dietary model conditions induced individual patient-specific strain signatures to prevent or cause inflammatory bowel disease (IBD)-like inflammation in gnotobiotic mice. Hence, we provide evidence that EEN therapy operates through explicit functional changes of temporally and individually variable microbiome profiles.
中文翻译:

独家肠内营养启动个体保护性微生物组变化,诱导小儿克罗恩病缓解
独家肠内营养 (EEN) 是小儿克罗恩病 (CD) 的一线疗法,但保护机制仍不清楚。我们建立了一个前瞻性儿科队列,以表征初治 CD 患者对 EEN (德国临床试验 DRKS00013306) 的粪便微生物群和代谢物变化的功能。综合多组学分析从个体可变的微生物组谱中确定了网络集群,其中毛螺菌科和中链脂肪酸作为保护特征。生物正交非经典氨基酸标记选择性地识别响应中链脂肪酸的细菌种类。宏基因组分析确定了响应 EEN 的高应变水平动力学。使用肠道恒化器培养和微生物群转移到无菌 Il10 缺陷小鼠中进一步验证了饮食暴露的粪便微生物群的功能变化。饮食模型条件诱导个体患者特异性菌株特征,以预防或导致 gnotobiotic 小鼠的炎症性肠病 (IBD) 样炎症。因此,我们提供的证据表明 EEN 疗法通过时间和个体可变微生物组谱的明确功能变化起作用。
更新日期:2024-10-25
中文翻译:

独家肠内营养启动个体保护性微生物组变化,诱导小儿克罗恩病缓解
独家肠内营养 (EEN) 是小儿克罗恩病 (CD) 的一线疗法,但保护机制仍不清楚。我们建立了一个前瞻性儿科队列,以表征初治 CD 患者对 EEN (德国临床试验 DRKS00013306) 的粪便微生物群和代谢物变化的功能。综合多组学分析从个体可变的微生物组谱中确定了网络集群,其中毛螺菌科和中链脂肪酸作为保护特征。生物正交非经典氨基酸标记选择性地识别响应中链脂肪酸的细菌种类。宏基因组分析确定了响应 EEN 的高应变水平动力学。使用肠道恒化器培养和微生物群转移到无菌 Il10 缺陷小鼠中进一步验证了饮食暴露的粪便微生物群的功能变化。饮食模型条件诱导个体患者特异性菌株特征,以预防或导致 gnotobiotic 小鼠的炎症性肠病 (IBD) 样炎症。因此,我们提供的证据表明 EEN 疗法通过时间和个体可变微生物组谱的明确功能变化起作用。






























 京公网安备 11010802027423号
京公网安备 11010802027423号