Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
视黄酸和 TGF-β 协调器官特异性组织驻留程序
Immunity ( IF 25.5 ) Pub Date : 2024-10-14 , DOI: 10.1016/j.immuni.2024.09.015
Andreas Obers 1 , Tobias Poch 1 , Grace Rodrigues 2 , Susan N Christo 1 , Luke C Gandolfo 3 , Raissa Fonseca 1 , Ali Zaid 1 , Joey En Yu Kuai 1 , Hongjin Lai 4 , Pirooz Zareie 1 , Marina H Yakou 5 , Lachlan Dryburgh 1 , Thomas N Burn 1 , James Dosser 1 , Frank A Buquicchio 6 , Caleb A Lareau 6 , Calum Walsh 1 , Louise Judd 1 , Maria Rafailia Theodorou 7 , Katharina Gutbrod 8 , Peter Dörmann 8 , Jenny Kingham 9 , Tim Stinear 1 , Axel Kallies 1 , Jan Schroeder 1 , Scott N Mueller 1 , Simone L Park 10 , Terence P Speed 11 , Ansuman T Satpathy 12 , Tri Giang Phan 13 , Christoph Wilhelm 7 , Colby Zaph 2 , Maximilien Evrard 1 , Laura K Mackay 1
Affiliation
|
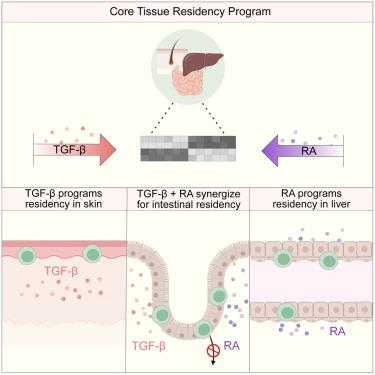
组织驻留记忆 T (TRM) 细胞是组织免疫不可或缺的一部分,它们存在于不同的解剖部位,在那里它们粘附于一个共同的转录框架。这些细胞如何整合不同的局部线索以适应共同的 TRM 细胞命运仍然知之甚少。在这里,我们表明,虽然皮肤 TRM 细胞严格需要转化生长因子 β (TGF-β) 才能进行组织驻留,但其他位置的细胞利用代谢物视黄酸 (RA) 来驱动另一种分化途径,指导肝脏中 TGF β非依赖性组织驻留程序,并与 TGF-β协同驱动小肠中的 TRM 细胞。我们发现 RA 是肠道 TRM 群体长期维持所必需的,部分原因是通过阻碍它们的逆行迁移。此外,增强的 RA 信号传导调节了 TRM 细胞表型和功能,这种现象在微生物多样性增加的小鼠中得到了反映。总之,我们的研究结果揭示了 RA 是指导组织中免疫监视的宿主-环境相互作用的基本组成部分。

"点击查看英文标题和摘要"

































 京公网安备 11010802027423号
京公网安备 11010802027423号