Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Ion-Engineered Clay Nanozyme via Tumor Microenvironment Remodeling for Enhanced Tumor Therapy
Small ( IF 13.0 ) Pub Date : 2024-10-07 , DOI: 10.1002/smll.202402648
Shiqi Wei 1, 2, 3 , Yiting Yuan 1, 2, 3 , Weimin Xie 4 , Juan Liao 4 , Rui Li 1, 2, 3 , Ying Chen 1, 2, 3 , Huaming Yang 1, 2, 3, 4
Small ( IF 13.0 ) Pub Date : 2024-10-07 , DOI: 10.1002/smll.202402648
Shiqi Wei 1, 2, 3 , Yiting Yuan 1, 2, 3 , Weimin Xie 4 , Juan Liao 4 , Rui Li 1, 2, 3 , Ying Chen 1, 2, 3 , Huaming Yang 1, 2, 3, 4
Affiliation
|
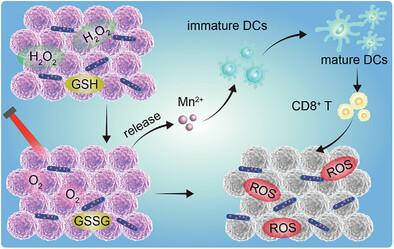
Metal ions show tremendous promise for tumor therapy due to their critical roles in many important catalytic circulations and immune processes. However, the valence state variability and systemic side-effects of metal ions cause ineffective ion enrichment in tumor cells, which limit their further application. Here, a Mn3+ ion delivery system (Mn-HNT) is constructed based on halloysite nanotubes (HNT) via an ion-engineered strategy. Due to the stabilizing effect of HNT on Mn3+ ions, Mn-HNT not only maintained the valence state of Mn3+ ions, but also presented strong catalase (CAT)- and glutathione oxidase (GSHOx)-like catalytic activity to catalyze O2 generation and GSH consumption to relieve the inhibition of tumor microenvironment on photodynamic therapy (PDT). After further coordination with the photosensitizer porphyrin (TCPP), obtained TCPP-Mn-HNT not only inherited the catalytic properties of Mn-HNT to produce oxygen and consume GSH, but acted as photosensitizer for ROS accumulation to effectively destroy tumor cells. Moreover, TCPP-Mn-HNT can promote the maturation of dendritic cells (≈2.8 times), and present the tumor antigen triggered by PDT to T cells to strengthen high-efficient tumor therapy. The study provides new opportunities for designing metal ion delivery system with versatile biofunctions and offers a paradigm of synergistic metal-ion-mediated tumor therapy.
中文翻译:

通过肿瘤微环境重塑的离子工程粘土纳米酶用于增强肿瘤治疗
金属离子在许多重要的催化循环和免疫过程中发挥着关键作用,因此在肿瘤治疗方面显示出巨大的前景。然而,金属离子的价态变异性和全身副作用导致肿瘤细胞中无效的离子富集,这限制了它们的进一步应用。在这里,通过离子工程策略基于埃洛石纳米管 (HNT) 构建了 Mn3+ 离子输送系统 (Mn-HNT)。由于 HNT 对 Mn3+ 离子的稳定作用,Mn-HNT 不仅维持了 Mn3+ 离子的价态,还表现出强过氧化氢酶 (CAT) 和谷胱甘肽氧化酶 (GSHOx) 样催化活性,催化 O2 生成和 GSH 消耗,以解除光动力疗法 (PDT) 对肿瘤微环境的抑制。在与光敏剂卟啉 (TCPP) 进一步配位后,获得的 TCPP-Mn-HNT 不仅继承了 Mn-HNT 产生氧气和消耗 GSH 的催化特性,而且作为 ROS 积累的光敏剂,有效破坏肿瘤细胞。此外,TCPP-Mn-HNT 可以促进树突状细胞的成熟(≈2.8 倍),并将 PDT 触发的肿瘤抗原呈递给 T 细胞,以加强高效肿瘤治疗。该研究为设计具有多种生物功能的金属离子递送系统提供了新的机会,并提供了协同金属离子介导的肿瘤治疗的范例。
更新日期:2024-10-07
中文翻译:

通过肿瘤微环境重塑的离子工程粘土纳米酶用于增强肿瘤治疗
金属离子在许多重要的催化循环和免疫过程中发挥着关键作用,因此在肿瘤治疗方面显示出巨大的前景。然而,金属离子的价态变异性和全身副作用导致肿瘤细胞中无效的离子富集,这限制了它们的进一步应用。在这里,通过离子工程策略基于埃洛石纳米管 (HNT) 构建了 Mn3+ 离子输送系统 (Mn-HNT)。由于 HNT 对 Mn3+ 离子的稳定作用,Mn-HNT 不仅维持了 Mn3+ 离子的价态,还表现出强过氧化氢酶 (CAT) 和谷胱甘肽氧化酶 (GSHOx) 样催化活性,催化 O2 生成和 GSH 消耗,以解除光动力疗法 (PDT) 对肿瘤微环境的抑制。在与光敏剂卟啉 (TCPP) 进一步配位后,获得的 TCPP-Mn-HNT 不仅继承了 Mn-HNT 产生氧气和消耗 GSH 的催化特性,而且作为 ROS 积累的光敏剂,有效破坏肿瘤细胞。此外,TCPP-Mn-HNT 可以促进树突状细胞的成熟(≈2.8 倍),并将 PDT 触发的肿瘤抗原呈递给 T 细胞,以加强高效肿瘤治疗。该研究为设计具有多种生物功能的金属离子递送系统提供了新的机会,并提供了协同金属离子介导的肿瘤治疗的范例。

































 京公网安备 11010802027423号
京公网安备 11010802027423号