Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Mechanism of phospho-Ubls’ specificity and conformational changes that regulate Parkin activity
Structure ( IF 4.4 ) Pub Date : 2024-10-04 , DOI: 10.1016/j.str.2024.09.012 Dipti Ranjan Lenka, Shradha Chaurasiya, Loknath Ratnakar, Atul Kumar
Structure ( IF 4.4 ) Pub Date : 2024-10-04 , DOI: 10.1016/j.str.2024.09.012 Dipti Ranjan Lenka, Shradha Chaurasiya, Loknath Ratnakar, Atul Kumar
|
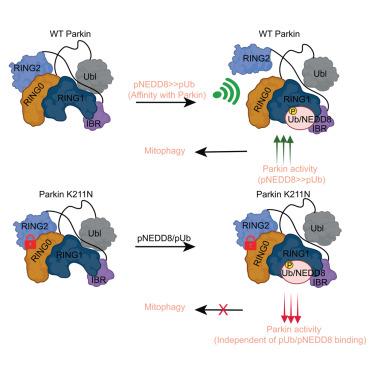
PINK1 and Parkin mutations lead to the early onset of Parkinson’s disease. PINK1-mediated phosphorylation of ubiquitin (Ub), ubiquitin-like protein (NEDD8), and ubiquitin-like (Ubl) domain of Parkin activate autoinhibited Parkin E3 ligase. The mechanism of various phospho-Ubls’ specificity and conformational changes leading to Parkin activation remain elusive. Herein, we show that compared to Ub, NEDD8 is a more robust binder and activator of Parkin. Structures and biophysical/biochemical data reveal specific recognition and underlying mechanisms of pUb/pNEDD8 and pUbl domain binding to the RING1 and RING0 domains, respectively. Also, pUb/pNEDD8 binding in the RING1 pocket promotes allosteric conformational changes in Parkin’s catalytic domain (RING2), leading to Parkin activation. Furthermore, Parkinson’s disease mutation K211N in the RING0 domain was believed to perturb Parkin activation due to loss of pUb binding. However, our data reveal allosteric conformational changes due to N211 that lock RING2 with RING0 to inhibit Parkin activity without disrupting pNEDD8/pUb binding.
中文翻译:

磷酸化 Ubls 的特异性机制和调节 Parkin 活性的构象变化
PINK1 和 Parkin 突变导致帕金森病的早期发作。PINK1 介导的泛素 (Ub)、泛素样蛋白 (NEDD8) 和 Parkin 泛素样 (Ubl) 结构域的磷酸化激活了自体抑制的 Parkin E3 连接酶。各种磷酸化 Ubls 的特异性机制和导致 Parkin 激活的构象变化仍然难以捉摸。在此,我们表明,与 Ub 相比,NEDD8 是 Parkin 的更强大的结合剂和激活剂。结构和生物物理/生化数据分别揭示了 pUb/pNEDD8 和 pUbl 结构域与 RING1 和 RING0 结构域结合的特异性识别和潜在机制。此外,RING1 口袋中的 pUb/pNEDD8 结合促进 Parkin 催化结构域 (RING2) 的变构象变化,从而导致 Parkin 激活。此外,RING0 结构域中的帕金森病突变 K211N 被认为由于 pUb 结合缺失而扰乱了 Parkin 激活。然而,我们的数据揭示了由于 N211 引起的变构构象变化,这些变化将 RING2 与 RING0 锁定以抑制 Parkin 活性,而不会破坏 pNEDD8/pUb 结合。
更新日期:2024-10-04
中文翻译:

磷酸化 Ubls 的特异性机制和调节 Parkin 活性的构象变化
PINK1 和 Parkin 突变导致帕金森病的早期发作。PINK1 介导的泛素 (Ub)、泛素样蛋白 (NEDD8) 和 Parkin 泛素样 (Ubl) 结构域的磷酸化激活了自体抑制的 Parkin E3 连接酶。各种磷酸化 Ubls 的特异性机制和导致 Parkin 激活的构象变化仍然难以捉摸。在此,我们表明,与 Ub 相比,NEDD8 是 Parkin 的更强大的结合剂和激活剂。结构和生物物理/生化数据分别揭示了 pUb/pNEDD8 和 pUbl 结构域与 RING1 和 RING0 结构域结合的特异性识别和潜在机制。此外,RING1 口袋中的 pUb/pNEDD8 结合促进 Parkin 催化结构域 (RING2) 的变构象变化,从而导致 Parkin 激活。此外,RING0 结构域中的帕金森病突变 K211N 被认为由于 pUb 结合缺失而扰乱了 Parkin 激活。然而,我们的数据揭示了由于 N211 引起的变构构象变化,这些变化将 RING2 与 RING0 锁定以抑制 Parkin 活性,而不会破坏 pNEDD8/pUb 结合。


















































 京公网安备 11010802027423号
京公网安备 11010802027423号