当前位置:
X-MOL 学术
›
Mol. Microbiol.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Peptidoglycan Endopeptidase PBP7 Facilitates the Recruitment of FtsN to the Divisome and Promotes Peptidoglycan Synthesis in Escherichia coli
Molecular Microbiology ( IF 2.6 ) Pub Date : 2024-09-30 , DOI: 10.1111/mmi.15321 Xinwei Liu, Gabriela Boelter, Waldemar Vollmer, Manuel Banzhaf, Tanneke den Blaauwen
Molecular Microbiology ( IF 2.6 ) Pub Date : 2024-09-30 , DOI: 10.1111/mmi.15321 Xinwei Liu, Gabriela Boelter, Waldemar Vollmer, Manuel Banzhaf, Tanneke den Blaauwen
|
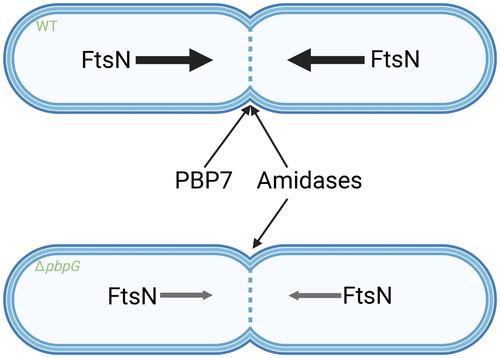
Escherichia coli has many periplasmic hydrolases to degrade and modify peptidoglycan (PG). However, the redundancy of eight PG endopeptidases makes it challenging to define specific roles to individual enzymes. Therefore, the cellular role of PBP7 (encoded by pbpG) is not clearly defined. In this work, we show that PBP7 localizes in the lateral cell envelope and at midcell. The C-terminal α-helix of PBP7 is crucial for midcell localization but not for its activity, which is dispensable for this localization. Additionally, midcell localization of PBP7 relies on the assembly of FtsZ up to FtsN in the divisome, and on the activity of PBP3. PBP7 was found to affect the assembly timing of FtsZ and FtsN in the divisome. The absence of PBP7 slows down the assembly of FtsN at midcell. The ΔpbpG mutant exhibited a weaker incorporation of the fluorescent D-amino acid HADA, reporting on transpeptidase activity, compared to wild-type cells. This could indicate reduced PG synthesis at the septum of the ΔpbpG strain, explaining the slower accumulation of FtsN and suggesting that endopeptidase-mediated PG cleavage may be a rate-limiting step for septal PG synthesis.
中文翻译:

肽聚糖内肽酶 PBP7 促进 FtsN 募集到分裂体并促进大肠杆菌中肽聚糖的合成
大肠杆菌有许多周质水解酶来降解和修饰肽聚糖 (PG)。然而,八种 PG 内肽酶的冗余使得定义单个酶的特定作用变得具有挑战性。因此,PBP7 (由 pbpG 编码) 的细胞作用尚未明确定义。在这项工作中,我们表明 PBP7 位于外侧细胞包膜和中细胞中。PBP7 的 C 端 α 螺旋对于中间细胞定位至关重要,但对其活性则不重要,而其活性对于这种定位是必不可少的。此外,PBP7 的中细胞定位依赖于 FtsZ 在分裂体中组装成 FtsN,以及 PBP3 的活性。发现 PBP7 影响分裂体中 FtsZ 和 FtsN 的组装时间。PBP7 的缺失减慢了 FtsN 在中细胞的组装。与野生型细胞相比,ΔpbpG 突变体表现出较弱的荧光 D-氨基酸 HADA 掺入,报告了转肽酶活性。这可能表明 ΔpbpG 菌株隔膜处的 PG 合成减少,解释了 FtsN 积累较慢,并表明内肽酶介导的 PG 切割可能是隔膜 PG 合成的限速步骤。
更新日期:2024-09-30
中文翻译:

肽聚糖内肽酶 PBP7 促进 FtsN 募集到分裂体并促进大肠杆菌中肽聚糖的合成
大肠杆菌有许多周质水解酶来降解和修饰肽聚糖 (PG)。然而,八种 PG 内肽酶的冗余使得定义单个酶的特定作用变得具有挑战性。因此,PBP7 (由 pbpG 编码) 的细胞作用尚未明确定义。在这项工作中,我们表明 PBP7 位于外侧细胞包膜和中细胞中。PBP7 的 C 端 α 螺旋对于中间细胞定位至关重要,但对其活性则不重要,而其活性对于这种定位是必不可少的。此外,PBP7 的中细胞定位依赖于 FtsZ 在分裂体中组装成 FtsN,以及 PBP3 的活性。发现 PBP7 影响分裂体中 FtsZ 和 FtsN 的组装时间。PBP7 的缺失减慢了 FtsN 在中细胞的组装。与野生型细胞相比,ΔpbpG 突变体表现出较弱的荧光 D-氨基酸 HADA 掺入,报告了转肽酶活性。这可能表明 ΔpbpG 菌株隔膜处的 PG 合成减少,解释了 FtsN 积累较慢,并表明内肽酶介导的 PG 切割可能是隔膜 PG 合成的限速步骤。































 京公网安备 11010802027423号
京公网安备 11010802027423号