Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
An AI-informed NMR structure reveals an extraordinary LETM1 F-EF-hand domain that functions as a two-way regulator of mitochondrial calcium
Structure ( IF 4.4 ) Pub Date : 2024-09-23 , DOI: 10.1016/j.str.2024.08.020 Qi-Tong Lin, Danielle M. Colussi, Taylor Lake, Peter B. Stathopulos
Structure ( IF 4.4 ) Pub Date : 2024-09-23 , DOI: 10.1016/j.str.2024.08.020 Qi-Tong Lin, Danielle M. Colussi, Taylor Lake, Peter B. Stathopulos
|
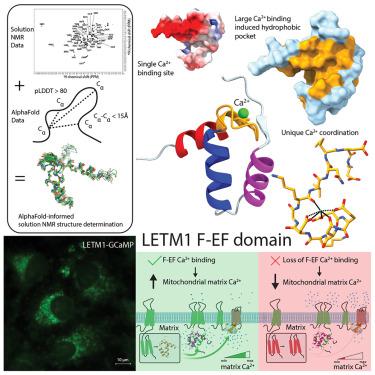
AlphaFold can accurately predict static protein structures but does not account for solvent conditions. Human leucine zipper EF-hand transmembrane protein-1 (LETM1) has one sequence-identifiable EF-hand but how calcium (Ca2+ ) affects structure and function remains enigmatic. Here, we used highly confident AlphaFold Cα predictions to guide nuclear Overhauser effect (NOE) assignments and structure calculation of the LETM1 EF-hand in the presence of Ca2+ . The resultant NMR structure exposes pairing between a partial loop-helix and full helix-loop-helix, forming an unprecedented F-EF-hand with non-canonical Ca2+ coordination but enhanced hydrophobicity for protein interactions compared to calmodulin. The structure also reveals the basis for pH sensing at the link between canonical and partial EF-hands. Functionally, mutations that augmented or weakened Ca2+ binding increased or decreased matrix Ca2+ , respectively, establishing F-EF as a two-way mitochondrial Ca2+ regulator. Thus, we show how to synergize AI prediction with NMR data, elucidating a solution-specific and extraordinary LETM1 F-EF-hand.
中文翻译:

AI 知情的 NMR 结构揭示了一个非凡的 LETM1 F-EF 手结构域,该结构域充当线粒体钙的双向调节因子
AlphaFold 可以准确预测静态蛋白质结构,但不考虑溶剂条件。人亮氨酸拉链 EF 手跨膜蛋白 1 (LETM1) 有一个序列可识别的 EF 手,但钙 (Ca2+) 如何影响结构和功能仍然是个谜。在这里,我们使用高度可信的 AlphaFold Cα 预测来指导在 Ca 2+ 存在下 LETM1 EF 手的核 Overhauser 效应 (NOE) 分配和结构计算。所得的 NMR 结构揭示了部分环螺旋和全螺旋环螺旋之间的配对,形成了前所未有的 F-EF 手,具有非经典 Ca2+ 配位,但与钙调蛋白相比,蛋白质相互作用的疏水性增强。该结构还揭示了典型 EF 指针和部分 EF 指针之间链接的 pH 传感基础。在功能上,增强或减弱 Ca2 + 结合的突变分别增加或减少基质 Ca2 +,从而将 F-EF 确立为双向线粒体 Ca2 + 调节因子。因此,我们展示了如何将 AI 预测与 NMR 数据协同作用,阐明了特定于解决方案的非凡 LETM1 F-EF-hand。
更新日期:2024-09-23
中文翻译:

AI 知情的 NMR 结构揭示了一个非凡的 LETM1 F-EF 手结构域,该结构域充当线粒体钙的双向调节因子
AlphaFold 可以准确预测静态蛋白质结构,但不考虑溶剂条件。人亮氨酸拉链 EF 手跨膜蛋白 1 (LETM1) 有一个序列可识别的 EF 手,但钙 (Ca2+) 如何影响结构和功能仍然是个谜。在这里,我们使用高度可信的 AlphaFold Cα 预测来指导在 Ca 2+ 存在下 LETM1 EF 手的核 Overhauser 效应 (NOE) 分配和结构计算。所得的 NMR 结构揭示了部分环螺旋和全螺旋环螺旋之间的配对,形成了前所未有的 F-EF 手,具有非经典 Ca2+ 配位,但与钙调蛋白相比,蛋白质相互作用的疏水性增强。该结构还揭示了典型 EF 指针和部分 EF 指针之间链接的 pH 传感基础。在功能上,增强或减弱 Ca2 + 结合的突变分别增加或减少基质 Ca2 +,从而将 F-EF 确立为双向线粒体 Ca2 + 调节因子。因此,我们展示了如何将 AI 预测与 NMR 数据协同作用,阐明了特定于解决方案的非凡 LETM1 F-EF-hand。


















































 京公网安备 11010802027423号
京公网安备 11010802027423号