Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Vibration mixing for enhanced paper-based recombinase polymerase amplification
Lab on a Chip ( IF 6.1 ) Pub Date : 2024-09-20 , DOI: 10.1039/d4lc00592a Kelli N. Shimazu, Andrew T. Bender, Per G. Reinhall, Jonathan D. Posner
Lab on a Chip ( IF 6.1 ) Pub Date : 2024-09-20 , DOI: 10.1039/d4lc00592a Kelli N. Shimazu, Andrew T. Bender, Per G. Reinhall, Jonathan D. Posner
|
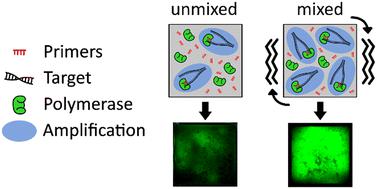
Isothermal nucleic acid amplification tests (NAATs) are a vital tool for point-of-care (POC) diagnostics. These assays are well-suited for rapid, low-cost POC diagnostics for infectious diseases compared to traditional PCR tests conducted in central laboratories. There has been significant development of POC NAATs using paper-based diagnostic devices because they provide an affordable, user-friendly, and easy to store format; however, the difficulties in integrating separate liquid components, resuspending dried reagents, and achieving a low limit of detection hinder their use in commercial applications. Several studies report low assay efficiencies, poor detection output, and poorer limits of detection in porous membranes compared to traditional tube-based protocols. Recombinase polymerase amplification is a rapid, isothermal NAAT that is highly suited for POC applications, but requires viscous reaction conditions that has poor performance when amplifying in a porous paper membrane. In this work, we show that we can dramatically improve the performance of membrane-based recombinase polymerase amplification (RPA) of HIV-1 DNA and viral RNA by employing a coin cell-based vibration mixing platform. We achieve a limit of detection of 12 copies of DNA per reaction, nearly 50% reduction in time to threshold (from ∼10 minutes to ∼5 minutes), and an overall fluorescence output increase up to 16-fold when compared to unmixed experiments. This active mixing strategy enables reactions where the target and reaction cofactors are isolated from each other prior to the reaction. We also demonstrate amplification using a low-cost vibration motor for both temperature control and mixing, without the requirement of any additional heating components.
中文翻译:

用于增强纸基重组酶聚合酶扩增的振动混合
等温核酸扩增检测 (NAAT) 是即时 (POC) 诊断的重要工具。与在中心实验室进行的传统 PCR 检测相比,这些检测非常适合快速、低成本的传染病 POC 诊断。使用纸质诊断设备的 POC NAAT 取得了重大发展,因为它们提供了一种经济实惠、用户友好且易于存储的格式;然而,整合单独的液体组分、重悬干燥试剂和实现低检测限的困难阻碍了它们在商业应用中的使用。几项研究报告称,与传统的基于试管的方案相比,多孔膜的检测效率低、检测输出差且检测限较差。重组酶聚合酶扩增是一种快速、等温的 NAAT,非常适合 POC 应用,但需要粘性反应条件,在多孔纸膜中扩增时性能较差。在这项工作中,我们表明,通过采用基于纽扣细胞的振动混合平台,我们可以显着提高 HIV-1 DNA 和病毒 RNA 的基于膜的重组酶聚合酶扩增 (RPA) 的性能。我们实现了每个反应 12 拷贝 DNA 的检测限,达到阈值的时间缩短了近 50%(从 ∼10 分钟缩短到 ∼5 分钟),与未混合实验相比,总荧光输出增加了 16 倍。这种主动混合策略可在反应前将靶标和反应辅因子彼此分离。我们还演示了使用低成本振动电机进行温度控制和混合的放大,而无需任何额外的加热组件。
更新日期:2024-09-20
中文翻译:

用于增强纸基重组酶聚合酶扩增的振动混合
等温核酸扩增检测 (NAAT) 是即时 (POC) 诊断的重要工具。与在中心实验室进行的传统 PCR 检测相比,这些检测非常适合快速、低成本的传染病 POC 诊断。使用纸质诊断设备的 POC NAAT 取得了重大发展,因为它们提供了一种经济实惠、用户友好且易于存储的格式;然而,整合单独的液体组分、重悬干燥试剂和实现低检测限的困难阻碍了它们在商业应用中的使用。几项研究报告称,与传统的基于试管的方案相比,多孔膜的检测效率低、检测输出差且检测限较差。重组酶聚合酶扩增是一种快速、等温的 NAAT,非常适合 POC 应用,但需要粘性反应条件,在多孔纸膜中扩增时性能较差。在这项工作中,我们表明,通过采用基于纽扣细胞的振动混合平台,我们可以显着提高 HIV-1 DNA 和病毒 RNA 的基于膜的重组酶聚合酶扩增 (RPA) 的性能。我们实现了每个反应 12 拷贝 DNA 的检测限,达到阈值的时间缩短了近 50%(从 ∼10 分钟缩短到 ∼5 分钟),与未混合实验相比,总荧光输出增加了 16 倍。这种主动混合策略可在反应前将靶标和反应辅因子彼此分离。我们还演示了使用低成本振动电机进行温度控制和混合的放大,而无需任何额外的加热组件。


















































 京公网安备 11010802027423号
京公网安备 11010802027423号