Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Reversible bonding in thermoplastic elastomer microfluidic platforms for harvestable 3D microvessel networks
Lab on a Chip ( IF 6.1 ) Pub Date : 2024-09-18 , DOI: 10.1039/d4lc00530a Byeong-Ui Moon 1, 2 , Kebin Li 1, 2 , Lidija Malic 1, 2, 3 , Keith Morton 1, 2 , Han Shao 4 , Lauren Banh 5, 6, 7 , Sowmya Viswanathan 5, 6, 7 , Edmond W K Young 4, 5 , Teodor Veres 1, 2, 4
Lab on a Chip ( IF 6.1 ) Pub Date : 2024-09-18 , DOI: 10.1039/d4lc00530a Byeong-Ui Moon 1, 2 , Kebin Li 1, 2 , Lidija Malic 1, 2, 3 , Keith Morton 1, 2 , Han Shao 4 , Lauren Banh 5, 6, 7 , Sowmya Viswanathan 5, 6, 7 , Edmond W K Young 4, 5 , Teodor Veres 1, 2, 4
Affiliation
|
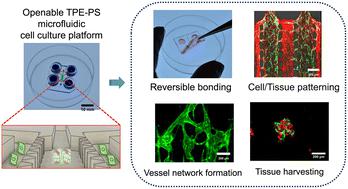
Transplantable ready-made microvessels have therapeutic potential for tissue regeneration and cell replacement therapy. Inspired by the natural rapid angiogenic sprouting of microvessels in vivo, engineered injectable 3D microvessel networks are created using thermoplastic elastomer (TPE) microfluidic devices. The TPE material used here is flexible, optically transparent, and can be robustly yet reversibly bonded to a variety of plastic substrates, making it a versatile choice for microfluidic device fabrication because it overcomes the weak self-adhesion properties and limited manufacturing options of poly(dimethylsiloxane) (PDMS). By leveraging the reversible bonding characteristics of TPE material templates, we present their utility as an organ-on-a-chip platform for forming and handling microvessel networks, and demonstrate their potential for animal-free tissue generation and transplantation in clinical applications. We first show that TPE-based devices have nearly 6-fold higher bonding strength during the cell culture step compared to PDMS-based devices while simultaneously maintaining a full reversible bond to (PS) culture plates, which are widely used for biological cell studies. We also demonstrate the successful generation of perfusable and interconnected 3D microvessel networks using TPE–PS microfluidic devices on both single and multi-vessel loading platforms. Importantly, after removing the TPE slab, microvessel networks remain intact on the PS substrate without any structural damage and can be effectively harvested following gel digestion. The TPE-based organ-on-a-chip platform offers substantial advantages by facilitating the harvesting procedure and maintaining the integrity of microfluidic-engineered microvessels for transplant. To the best of our knowledge, our TPE-based reversible bonding approach marks the first confirmation of successful retrieval of organ-specific vessel segments from the reversibly-bonded TPE microfluidic platform. We anticipate that the method will find applications in organ-on-a-chip and microphysiological system research, particularly in tissue analysis and vessel engraftment, where flexible and reversible bonding can be utilized.
中文翻译:

热塑性弹性体微流控平台中的可逆粘合,用于可收获的 3D 微血管网络
可移植的现成微血管具有组织再生和细胞替代疗法的治疗潜力。受微血管在体内自然快速血管生成发芽的启发,使用热塑性弹性体 (TPE) 微流体器件创建了工程可注射 3D 微血管网络。这里使用的 TPE 材料具有柔韧性、光学透明性,并且可以坚固但可逆地粘合到各种塑料基材上,使其成为微流体器件制造的多功能选择,因为它克服了聚二甲基硅氧烷 (PDMS) 的弱自粘性能和有限的制造选择。通过利用 TPE 材料模板的可逆粘合特性,我们展示了它们作为器官芯片平台的用途,用于形成和处理微血管网络,并展示了它们在临床应用中无动物组织生成和移植的潜力。我们首先表明,与基于 PDMS 的装置相比,基于 TPE 的装置在细胞培养步骤中的粘合强度高出近 6 倍,同时保持与广泛用于生物细胞研究的 (PS) 培养板的完全可逆粘合。我们还展示了在单容器和多容器加载平台上使用 TPE-PS 微流体设备成功生成可灌注和互连的 3D 微血管网络。重要的是,去除 TPE 板后,微血管网络在 PS 基材上保持完整,没有任何结构损伤,并且可以在凝胶消化后有效收获。基于 TPE 的器官芯片平台通过促进收获程序和保持用于移植的微流体工程微血管的完整性,提供了巨大的优势。 据我们所知,我们基于 TPE 的可逆粘合方法标志着首次确认从可逆粘合的 TPE 微流体平台中成功检索器官特异性血管段。我们预计该方法将应用于器官芯片和微生理系统研究,特别是组织分析和血管植入,其中可以使用柔性和可逆粘合。
更新日期:2024-09-18
中文翻译:

热塑性弹性体微流控平台中的可逆粘合,用于可收获的 3D 微血管网络
可移植的现成微血管具有组织再生和细胞替代疗法的治疗潜力。受微血管在体内自然快速血管生成发芽的启发,使用热塑性弹性体 (TPE) 微流体器件创建了工程可注射 3D 微血管网络。这里使用的 TPE 材料具有柔韧性、光学透明性,并且可以坚固但可逆地粘合到各种塑料基材上,使其成为微流体器件制造的多功能选择,因为它克服了聚二甲基硅氧烷 (PDMS) 的弱自粘性能和有限的制造选择。通过利用 TPE 材料模板的可逆粘合特性,我们展示了它们作为器官芯片平台的用途,用于形成和处理微血管网络,并展示了它们在临床应用中无动物组织生成和移植的潜力。我们首先表明,与基于 PDMS 的装置相比,基于 TPE 的装置在细胞培养步骤中的粘合强度高出近 6 倍,同时保持与广泛用于生物细胞研究的 (PS) 培养板的完全可逆粘合。我们还展示了在单容器和多容器加载平台上使用 TPE-PS 微流体设备成功生成可灌注和互连的 3D 微血管网络。重要的是,去除 TPE 板后,微血管网络在 PS 基材上保持完整,没有任何结构损伤,并且可以在凝胶消化后有效收获。基于 TPE 的器官芯片平台通过促进收获程序和保持用于移植的微流体工程微血管的完整性,提供了巨大的优势。 据我们所知,我们基于 TPE 的可逆粘合方法标志着首次确认从可逆粘合的 TPE 微流体平台中成功检索器官特异性血管段。我们预计该方法将应用于器官芯片和微生理系统研究,特别是组织分析和血管植入,其中可以使用柔性和可逆粘合。


















































 京公网安备 11010802027423号
京公网安备 11010802027423号