当前位置:
X-MOL 学术
›
Mol. Microbiol.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Multiple Effects of L-Leucine in Escherichia coli Lead to L-Leucine-Sensitive Growth in the Absence of Unphosphorylated PtsN
Molecular Microbiology ( IF 2.6 ) Pub Date : 2024-09-14 , DOI: 10.1111/mmi.15317 Neeraj Kumar 1, 2 , Abhijit A Sardesai 1
Molecular Microbiology ( IF 2.6 ) Pub Date : 2024-09-14 , DOI: 10.1111/mmi.15317 Neeraj Kumar 1, 2 , Abhijit A Sardesai 1
Affiliation
|
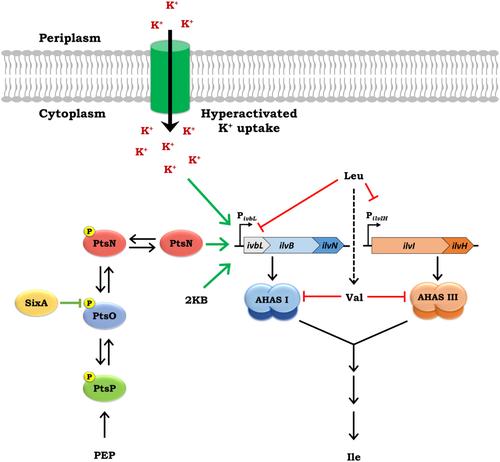
In E. coli K-12, the absence of unphosphorylated PtsN (unphospho-PtsN) has been proposed to cause an L-leucine-sensitive growth phenotype (LeuS) by hyperactivated K+ uptake mediated impairment of the expression of the ilvBN operon, encoding subunits of the L-valine (Val)-sensitive acetohydroxyacid synthase I (AHAS I) that renders residual AHAS activity susceptible to inhibition by Leu and K+. This leads to AHAS insufficiency and a requirement for L-isoleucine (Ile). Herein, we provide an alternate mechanism for the LeuS of the ∆ptsN mutant. Genetic and physiological studies with suppressors of the LeuS indicate that impaired expression of the ilvBN operon jointly caused by the absence of unphospho-PtsN and the presence of Leu coupled to Leu-mediated repression of expression of AHAS III leads to AHAS insufficiency rendering residual AHAS activity susceptible to chronic Val stress that may be generated by exogenous Leu. Hyperactivated K+ uptake and an elevated α-ketobutyrate level mediate elevation of ilvBN expression and alleviate the LeuS. The requirement of unphospho-PtsN as a positive regulator of ilvBN expression may buffer Ile biosynthesis against Leu-mediated AHAS insufficiency and protect AHAS I function from chronic endogenous Val generated by Leu and could be realized in certain environments that impair AHAS function.
中文翻译:

L-亮氨酸在大肠杆菌中的多种作用导致在没有未磷酸化 PtsN 的情况下 L-亮氨酸敏感生长
在大肠杆菌 K-12 中,未磷酸化的 PtsN (unphospho-PtsN) 的缺失被认为会导致 L-亮氨酸敏感的生长表型 (LeuS),这是由于过度激活的 K+ 摄取介导的 ilvBN 操纵子表达受损,编码 L-缬氨酸 (Val) 敏感的乙酰羟基酸合酶 I (AHAS I) 的亚基,使残留的 AHAS 活性容易受到 Leu 和 K+ 的抑制.这会导致 AHAS 功能不足和对 L-异亮氨酸 (Ile) 的需求。在此,我们提供了 ∆ptsN 突变体的 LeuS 的替代机制。对 LeuS 抑制因子的遗传学和生理学研究表明,由单磷酸化 PtsN 的存在和 Leu 的存在与 Leu 介导的 AHAS III 表达抑制相结合共同导致 ALHAS 不足,使残留的 AHAS 活性容易受到可能由外源性 Leu 产生的慢性 Val 应激的影响。K+ 摄取过度激活和 α-酮丁酸水平升高介导 ilvBN 表达升高并减轻 LeuS。要求非磷酸化 PtsN 作为 ilvBN 表达的正调节因子可以缓冲 Ile 生物合成对抗 Leu 介导的 AHAS 不足,并保护 AHAS I 功能免受 Leu 产生的慢性内源性 Val 的影响,并且可以在某些损害 AHAS 功能的环境中实现。
更新日期:2024-09-14
中文翻译:

L-亮氨酸在大肠杆菌中的多种作用导致在没有未磷酸化 PtsN 的情况下 L-亮氨酸敏感生长
在大肠杆菌 K-12 中,未磷酸化的 PtsN (unphospho-PtsN) 的缺失被认为会导致 L-亮氨酸敏感的生长表型 (LeuS),这是由于过度激活的 K+ 摄取介导的 ilvBN 操纵子表达受损,编码 L-缬氨酸 (Val) 敏感的乙酰羟基酸合酶 I (AHAS I) 的亚基,使残留的 AHAS 活性容易受到 Leu 和 K+ 的抑制.这会导致 AHAS 功能不足和对 L-异亮氨酸 (Ile) 的需求。在此,我们提供了 ∆ptsN 突变体的 LeuS 的替代机制。对 LeuS 抑制因子的遗传学和生理学研究表明,由单磷酸化 PtsN 的存在和 Leu 的存在与 Leu 介导的 AHAS III 表达抑制相结合共同导致 ALHAS 不足,使残留的 AHAS 活性容易受到可能由外源性 Leu 产生的慢性 Val 应激的影响。K+ 摄取过度激活和 α-酮丁酸水平升高介导 ilvBN 表达升高并减轻 LeuS。要求非磷酸化 PtsN 作为 ilvBN 表达的正调节因子可以缓冲 Ile 生物合成对抗 Leu 介导的 AHAS 不足,并保护 AHAS I 功能免受 Leu 产生的慢性内源性 Val 的影响,并且可以在某些损害 AHAS 功能的环境中实现。






























 京公网安备 11010802027423号
京公网安备 11010802027423号