当前位置:
X-MOL 学术
›
J. Agric. Food Chem.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
High Salt-Resistant Urethanase Degrades Ethyl Carbamate in Soy Sauce
Journal of Agricultural and Food Chemistry ( IF 5.7 ) Pub Date : 2024-09-13 , DOI: 10.1021/acs.jafc.4c06162 Qingtao Liu 1, 2 , Han Wang 1 , Wenqing Zhang 3 , Fan Cheng 3 , Senhe Qian 1 , Chuang Li 1 , Yu Chen 1 , Sibao Zhu 1 , Tianwen Wang 1, 2 , Shufang Tian 1, 2
Journal of Agricultural and Food Chemistry ( IF 5.7 ) Pub Date : 2024-09-13 , DOI: 10.1021/acs.jafc.4c06162 Qingtao Liu 1, 2 , Han Wang 1 , Wenqing Zhang 3 , Fan Cheng 3 , Senhe Qian 1 , Chuang Li 1 , Yu Chen 1 , Sibao Zhu 1 , Tianwen Wang 1, 2 , Shufang Tian 1, 2
Affiliation
|
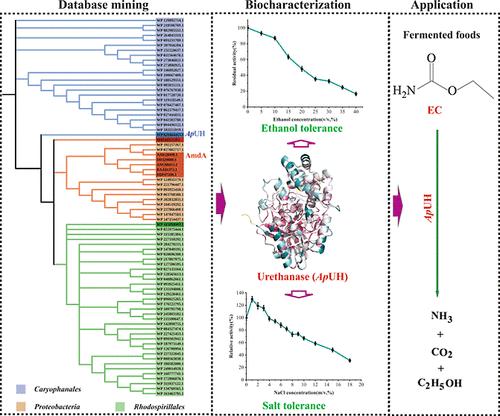
Urethanase is a promising biocatalyst for degrading carcinogen ethyl carbamate (EC) in fermented foods. However, their vulnerability to high ethanol and/or salt and acidic conditions severely limits their applications. In this study, a novel urethanase from Alicyclobacillus pomorum (ApUH) was successfully discovered using a database search. ApUH shares 49.4% sequence identity with the reported amino acid sequences. It belongs to the Amidase Signature family and has a conserved “K–S–S” catalytic triad and the characteristic “GGSS” motif. The purified enzyme overexpressed in Escherichia coli exhibits a high EC affinity (Km, 0.306 mM) and broad pH tolerance (pH 4.0–9.0), with an optimum pH 7.0. Enzyme activity remained at 58% in 12% (w/v) NaCl, and 80% in 10% (v/v) ethanol or after 1 h treatment with the same ethanol solution at 37 °C. ApUH has no hydrolytic activity toward urea. Under 30 °C, the purified enzyme (200 U/L) degraded about 15.4 and 43.1% of the EC in soy sauce samples (pH 5.0, 6.0), respectively, in 5 h. Furthermore, the enzyme also showed high activity toward the class 2A carcinogen acrylamide in foods. These attractive properties indicate their potential applications in the food industry.
中文翻译:

高耐盐氨基甲酸酯酶降解酱油中的氨基甲酸乙酯
尿烷酶是一种很有前景的生物催化剂,可用于降解发酵食品中的致癌物质氨基甲酸乙酯 (EC)。然而,它们对高乙醇和/或盐和酸性条件的脆弱性严重限制了它们的应用。在本研究中,通过数据库检索成功发现了一种来自脂环酸芽孢杆菌( Ap UH) 的新型氨基甲酸酯酶。 Ap UH 与报道的氨基酸序列有 49.4% 的序列同一性。它属于酰胺酶签名家族,具有保守的“K-S-S”催化三联体和特征性“GGSS”基序。在大肠杆菌中过表达的纯化酶具有高 EC 亲和力( K m ,0.306 mM)和广泛的 pH 耐受性(pH 4.0–9.0),最适 pH 为 7.0。酶活性在 12% (w/v) NaCl 中保持在 58%,在 10% (v/v) 乙醇中或在 37 °C 下用相同的乙醇溶液处理 1 小时后保持在 80%。 Ap UH 对尿素没有水解活性。在30℃下,纯化酶(200U/L)在5小时内分别降解了酱油样品(pH 5.0、6.0)中约15.4%和43.1%的EC。此外,该酶对食品中的 2A 类致癌物丙烯酰胺也表现出高活性。这些有吸引力的特性表明它们在食品工业中的潜在应用。
更新日期:2024-09-13
中文翻译:

高耐盐氨基甲酸酯酶降解酱油中的氨基甲酸乙酯
尿烷酶是一种很有前景的生物催化剂,可用于降解发酵食品中的致癌物质氨基甲酸乙酯 (EC)。然而,它们对高乙醇和/或盐和酸性条件的脆弱性严重限制了它们的应用。在本研究中,通过数据库检索成功发现了一种来自脂环酸芽孢杆菌( Ap UH) 的新型氨基甲酸酯酶。 Ap UH 与报道的氨基酸序列有 49.4% 的序列同一性。它属于酰胺酶签名家族,具有保守的“K-S-S”催化三联体和特征性“GGSS”基序。在大肠杆菌中过表达的纯化酶具有高 EC 亲和力( K m ,0.306 mM)和广泛的 pH 耐受性(pH 4.0–9.0),最适 pH 为 7.0。酶活性在 12% (w/v) NaCl 中保持在 58%,在 10% (v/v) 乙醇中或在 37 °C 下用相同的乙醇溶液处理 1 小时后保持在 80%。 Ap UH 对尿素没有水解活性。在30℃下,纯化酶(200U/L)在5小时内分别降解了酱油样品(pH 5.0、6.0)中约15.4%和43.1%的EC。此外,该酶对食品中的 2A 类致癌物丙烯酰胺也表现出高活性。这些有吸引力的特性表明它们在食品工业中的潜在应用。































 京公网安备 11010802027423号
京公网安备 11010802027423号