Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Minute-timescale free-energy calculations reveal a pseudo-active state in the adenosine A2A receptor activation mechanism
Chem ( IF 19.1 ) Pub Date : 2024-09-09 , DOI: 10.1016/j.chempr.2024.08.004 Vincenzo Maria D’Amore , Paolo Conflitti , Luciana Marinelli , Vittorio Limongelli
Chem ( IF 19.1 ) Pub Date : 2024-09-09 , DOI: 10.1016/j.chempr.2024.08.004 Vincenzo Maria D’Amore , Paolo Conflitti , Luciana Marinelli , Vittorio Limongelli
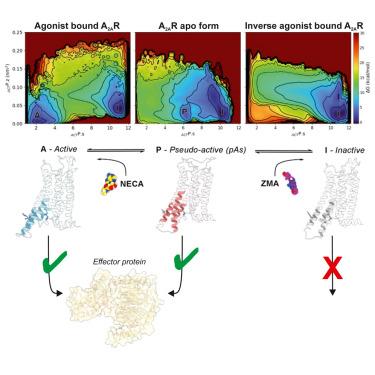
|
G protein-coupled receptors (GPCRs) are membrane proteins targeted by over one-third of marketed drugs. Understanding their activation mechanism is essential for precise regulation of drug pharmacological response. In this work, we elucidate the conformational landscape of the adenosine A2A receptor (A2A R) activation mechanism in its basal apo form and under different ligand-bound conditions through minute-timescale free-energy calculations. We identified a pseudo-active state (pAs) of the A2A R apo form, stabilized by specific “microswitch ” residues, including a salt bridge established between the conserved residues R5.66 and E6.30 . The pAs enables A2A R to couple with Gs protein upon rearrangement of the intracellular end of transmembrane helix 6, providing unprecedented structural insights into receptor function and signaling dynamics. Our simulation protocol is versatile and can be adapted to study the activation of any GPCRs, potentially making it a valuable tool for drug design and “biased signaling ” studies.
中文翻译:

分钟时间尺度自由能计算揭示了腺苷 A2A 受体激活机制中的伪活性状态
G 蛋白偶联受体 (GPCR) 是超过三分之一的市售药物靶向的膜蛋白。了解它们的激活机制对于精确调节药物药理反应至关重要。在这项工作中,我们通过分钟时间尺度自由能计算阐明了腺苷 A2A 受体 (A2AR) 激活机制在其基础载脂蛋白形式和不同配体结合条件下的构象景观。我们鉴定了 A2AR 载脂蛋白形式的伪活性态 (pAs),由特定的“微动开关”残基稳定,包括在保守残基 R5.66 和 E6.30 之间建立的盐桥。pAs 使 A2AR 能够在跨膜螺旋 6 的细胞内末端重排时与 Gs 蛋白偶联,从而为受体功能和信号动力学提供前所未有的结构见解。我们的模拟方案用途广泛,可用于研究任何 GPCR 的激活,可能使其成为药物设计和“偏向信号”研究的宝贵工具。
更新日期:2024-09-09
中文翻译:

分钟时间尺度自由能计算揭示了腺苷 A2A 受体激活机制中的伪活性状态
G 蛋白偶联受体 (GPCR) 是超过三分之一的市售药物靶向的膜蛋白。了解它们的激活机制对于精确调节药物药理反应至关重要。在这项工作中,我们通过分钟时间尺度自由能计算阐明了腺苷 A2A 受体 (A2AR) 激活机制在其基础载脂蛋白形式和不同配体结合条件下的构象景观。我们鉴定了 A2AR 载脂蛋白形式的伪活性态 (pAs),由特定的“微动开关”残基稳定,包括在保守残基 R5.66 和 E6.30 之间建立的盐桥。pAs 使 A2AR 能够在跨膜螺旋 6 的细胞内末端重排时与 Gs 蛋白偶联,从而为受体功能和信号动力学提供前所未有的结构见解。我们的模拟方案用途广泛,可用于研究任何 GPCR 的激活,可能使其成为药物设计和“偏向信号”研究的宝贵工具。

































 京公网安备 11010802027423号
京公网安备 11010802027423号