当前位置:
X-MOL 学术
›
Cell Host Microbe
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Paneth cell TNF signaling induces gut bacterial translocation and sepsis
Cell Host & Microbe ( IF 20.6 ) Pub Date : 2024-09-06 , DOI: 10.1016/j.chom.2024.08.007 Charlotte Wallaeys 1 , Natalia Garcia-Gonzalez 1 , Steven Timmermans 1 , Jolien Vandewalle 1 , Tineke Vanderhaeghen 1 , Somara De Beul 1 , Hester Dufoor 1 , Melanie Eggermont 1 , Elise Moens 1 , Victor Bosteels 2 , Riet De Rycke 3 , Fabien Thery 4 , Francis Impens 5 , Serge Verbanck 6 , Stefan Lienenklaus 7 , Sophie Janssens 2 , Richard S Blumberg 8 , Takao Iwawaki 9 , Claude Libert 1
Cell Host & Microbe ( IF 20.6 ) Pub Date : 2024-09-06 , DOI: 10.1016/j.chom.2024.08.007 Charlotte Wallaeys 1 , Natalia Garcia-Gonzalez 1 , Steven Timmermans 1 , Jolien Vandewalle 1 , Tineke Vanderhaeghen 1 , Somara De Beul 1 , Hester Dufoor 1 , Melanie Eggermont 1 , Elise Moens 1 , Victor Bosteels 2 , Riet De Rycke 3 , Fabien Thery 4 , Francis Impens 5 , Serge Verbanck 6 , Stefan Lienenklaus 7 , Sophie Janssens 2 , Richard S Blumberg 8 , Takao Iwawaki 9 , Claude Libert 1
Affiliation
|
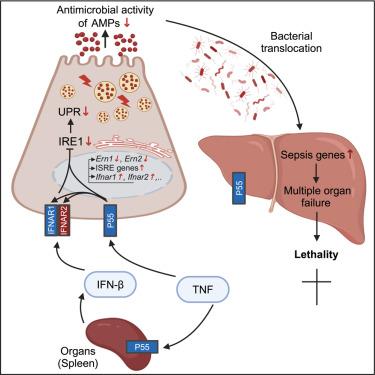
The cytokine tumor necrosis factor (TNF) plays important roles in limiting infection but is also linked to sepsis. The mechanisms underlying these paradoxical roles are unclear. Here, we show that TNF limits the antimicrobial activity of Paneth cells (PCs), causing bacterial translocation from the gut to various organs. This TNF-induced lethality does not occur in mice with a PC-specific deletion in the TNF receptor, P55. In PCs, TNF stimulates the IFN pathway and ablates the steady-state unfolded protein response (UPR), effects not observed in mice lacking P55 or IFNAR1. TNF triggers the transcriptional downregulation of IRE1 key genes Ern1 and Ern2, which are key mediators of the UPR. This UPR deficiency causes a significant reduction in antimicrobial peptide production and PC antimicrobial activity, causing bacterial translocation to organs and subsequent polymicrobial sepsis, organ failure, and death. This study highlights the roles of PCs in bacterial control and therapeutic targets for sepsis.
中文翻译:

潘氏细胞 TNF 信号诱导肠道细菌易位和脓毒症
细胞因子肿瘤坏死因子 (TNF) 在限制感染中起重要作用,但也与脓毒症有关。这些矛盾角色背后的机制尚不清楚。在这里,我们表明 TNF 限制了潘氏细胞 (PCs) 的抗菌活性,导致细菌从肠道转移到各个器官。这种 TNF 诱导的致死性不会发生在 TNF 受体 P55 中具有 PC 特异性缺失的小鼠中。在 PC 中,TNF 刺激 IFN 通路并消融稳态未折叠蛋白反应 (UPR),这在缺乏 P55 或 IFNAR1 的小鼠中未观察到。TNF 触发 IRE1 关键基因 Ern1 和 Ern2 的转录下调,它们是 UPR 的关键介质。这种 UPR 缺陷导致抗菌肽产生和 PC 抗菌活性显著降低,导致细菌易位到器官,随后出现多种微生物败血症、器官衰竭和死亡。本研究强调了 PC 在脓毒症细菌控制和治疗靶点中的作用。
更新日期:2024-09-06
中文翻译:

潘氏细胞 TNF 信号诱导肠道细菌易位和脓毒症
细胞因子肿瘤坏死因子 (TNF) 在限制感染中起重要作用,但也与脓毒症有关。这些矛盾角色背后的机制尚不清楚。在这里,我们表明 TNF 限制了潘氏细胞 (PCs) 的抗菌活性,导致细菌从肠道转移到各个器官。这种 TNF 诱导的致死性不会发生在 TNF 受体 P55 中具有 PC 特异性缺失的小鼠中。在 PC 中,TNF 刺激 IFN 通路并消融稳态未折叠蛋白反应 (UPR),这在缺乏 P55 或 IFNAR1 的小鼠中未观察到。TNF 触发 IRE1 关键基因 Ern1 和 Ern2 的转录下调,它们是 UPR 的关键介质。这种 UPR 缺陷导致抗菌肽产生和 PC 抗菌活性显著降低,导致细菌易位到器官,随后出现多种微生物败血症、器官衰竭和死亡。本研究强调了 PC 在脓毒症细菌控制和治疗靶点中的作用。































 京公网安备 11010802027423号
京公网安备 11010802027423号