当前位置:
X-MOL 学术
›
Cell Chem. Bio.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
A chemical screen identifies PRMT5 as a therapeutic vulnerability for paclitaxel-resistant triple-negative breast cancer
Cell Chemical Biology ( IF 6.6 ) Pub Date : 2024-09-03 , DOI: 10.1016/j.chembiol.2024.08.003 KeJing Zhang 1 , Juan Wei 2 , SheYu Zhang 3 , Liyan Fei 2 , Lu Guo 2 , Xueying Liu 2 , YiShuai Ji 3 , WenJun Chen 2 , Felipe E Ciamponi 4 , WeiChang Chen 2 , MengXi Li 5 , Jie Zhai 2 , Ting Fu 2 , Katlin B Massirer 4 , Yang Yu 2 , Mathieu Lupien 6 , Yong Wei 2 , Cheryl H Arrowsmith 7 , Qin Wu 2 , WeiHong Tan 2
Cell Chemical Biology ( IF 6.6 ) Pub Date : 2024-09-03 , DOI: 10.1016/j.chembiol.2024.08.003 KeJing Zhang 1 , Juan Wei 2 , SheYu Zhang 3 , Liyan Fei 2 , Lu Guo 2 , Xueying Liu 2 , YiShuai Ji 3 , WenJun Chen 2 , Felipe E Ciamponi 4 , WeiChang Chen 2 , MengXi Li 5 , Jie Zhai 2 , Ting Fu 2 , Katlin B Massirer 4 , Yang Yu 2 , Mathieu Lupien 6 , Yong Wei 2 , Cheryl H Arrowsmith 7 , Qin Wu 2 , WeiHong Tan 2
Affiliation
|
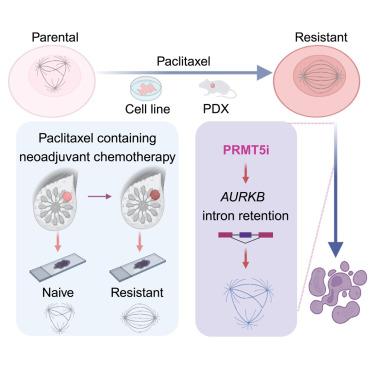
Paclitaxel-resistant triple negative breast cancer (TNBC) remains one of the most challenging breast cancers to treat. Here, using an epigenetic chemical probe screen, we uncover an acquired vulnerability of paclitaxel-resistant TNBC cells to protein arginine methyltransferases (PRMTs) inhibition. Analysis of cell lines and in-house clinical samples demonstrates that resistant cells evade paclitaxel killing through stabilizing mitotic chromatin assembly. Genetic or pharmacologic inhibition of PRMT5 alters RNA splicing, particularly intron retention of aurora kinases B (AURKB), leading to a decrease in protein expression, and finally results in selective mitosis catastrophe in paclitaxel-resistant cells. In addition, type I PRMT inhibition synergies with PRMT5 inhibition in suppressing tumor growth of drug-resistant cells through augmenting perturbation of AURKB-mediated mitotic signaling pathway. These findings are fully recapitulated in a patient-derived xenograft (PDX) model generated from a paclitaxel-resistant TNBC patient, providing the rationale for targeting PRMTs in paclitaxel-resistant TNBC.
中文翻译:

化学筛选确定 PRMT5 是紫杉醇耐药三阴性乳腺癌的治疗脆弱性
紫杉醇耐药的三阴性乳腺癌 (TNBC) 仍然是最具挑战性的乳腺癌治疗之一。在这里,使用表观遗传学探针筛选,我们揭示了紫杉醇耐药 TNBC 细胞对蛋白质精氨酸甲基转移酶 (PRMT) 抑制的获得性脆弱性。对细胞系和内部临床样本的分析表明,耐药细胞通过稳定有丝分裂染色质组装来逃避紫杉醇杀伤。PRMT5 的遗传或药物抑制会改变 RNA 剪接,特别是极光激酶 B (AURKB) 的内含子保留,导致蛋白质表达降低,并最终导致紫杉醇耐药细胞的选择性有丝分裂灾难。此外,I 型 PRMT 抑制与 PRMT5 抑制协同作用,通过增强 AURKB 介导的有丝分裂信号通路的扰动来抑制耐药细胞的肿瘤生长。这些发现完全概括在由紫杉醇耐药 TNBC 患者生成的患者来源的异种移植物 (PDX) 模型中,为在紫杉醇耐药 TNBC 中靶向 PRMT 提供了理论依据。
更新日期:2024-09-03
中文翻译:

化学筛选确定 PRMT5 是紫杉醇耐药三阴性乳腺癌的治疗脆弱性
紫杉醇耐药的三阴性乳腺癌 (TNBC) 仍然是最具挑战性的乳腺癌治疗之一。在这里,使用表观遗传学探针筛选,我们揭示了紫杉醇耐药 TNBC 细胞对蛋白质精氨酸甲基转移酶 (PRMT) 抑制的获得性脆弱性。对细胞系和内部临床样本的分析表明,耐药细胞通过稳定有丝分裂染色质组装来逃避紫杉醇杀伤。PRMT5 的遗传或药物抑制会改变 RNA 剪接,特别是极光激酶 B (AURKB) 的内含子保留,导致蛋白质表达降低,并最终导致紫杉醇耐药细胞的选择性有丝分裂灾难。此外,I 型 PRMT 抑制与 PRMT5 抑制协同作用,通过增强 AURKB 介导的有丝分裂信号通路的扰动来抑制耐药细胞的肿瘤生长。这些发现完全概括在由紫杉醇耐药 TNBC 患者生成的患者来源的异种移植物 (PDX) 模型中,为在紫杉醇耐药 TNBC 中靶向 PRMT 提供了理论依据。






























 京公网安备 11010802027423号
京公网安备 11010802027423号