当前位置:
X-MOL 学术
›
J. Adv. Res.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
IL-28A/IL-10Rβ axis promotes angiogenesis via eNOS/AKT signaling and AP-1/NF-κB/MMP-2 network by regulating HSP70-1 expression
Journal of Advanced Research ( IF 11.4 ) Pub Date : 2024-08-09 , DOI: 10.1016/j.jare.2024.08.013 Jun-Hui Song 1 , Byungdoo Hwang 1 , Sung Lyea Park 1 , Hoon Kim 1 , Soontag Jung 1 , Changsun Choi 1 , Hwan Myung Lee 2 , Seok-Joong Yun 3 , Yung Hyun Choi 4 , Eun-Jong Cha 5 , Cam Patterson 6 , Wun-Jae Kim 7 , Sung-Kwon Moon 1
中文翻译:

IL-28A/IL-10Rβ 轴通过调节 HSP70-1 表达,通过 eNOS/AKT 信号传导和 AP-1/NF-κB/MMP-2 网络促进血管生成
血管生成在肿瘤进展和炎症性疾病的发展中起着重要作用。IL-28A 在血管生成中的作用及其精确的调节机制仍然很少阐明。
我们报道了 IL-28A 在生理性血管生成中的新调节作用。该研究旨在阐明 IL-28A 介导的血管生成所涉及的调控机制,并确定与 IL-28A 诱导的血管生成反应相关的关键基因。
为了了解 IL-28A 对血管生成的影响,应用 HUVEC 进行增殖、迁移、侵袭、管形成、免疫印迹和 EMSA。通过 NGS 分析 IL-28A 处理后 HUVECs 的基因表达变化。使用 PCR 和 siRNA 敲低评估 HSP70-1 和 IL-10Rβ 在 IL-28A 诱导的血管生成反应中的功能作用。使用 HSP70-1 敲除和转基因小鼠模型,通过主动脉环离体试验、Matrigel 插入体内试验和免疫化学进行动物研究。IL-28A 在后肢缺血模型中证实了 IL-28A 在血管生成中的疗效。
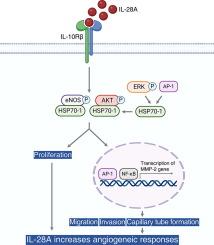
HUVECs 中的自分泌/旁分泌作用调节 IL-28A 蛋白表达。外源性 IL-28A 通过 eNOS/AKT 和 ERK1/2 信号传导增加 HUVECs 的增殖。IL-28A 治疗通过诱导 AP-1/NF-κB/MMP-2 网络促进 HUVECs 的迁移、侵袭和毛细管形成,这与 eNOS/AKT 和 ERK1/2 信号传导相关。IL-28A 诱导的血管生成电位的疗效通过主动脉环和基质胶栓试验得到证实。使用生物信息学将 HSP70-1 鉴定为 IL-28A 介导的血管生成效应基因。敲除 HSP70-1 消除了 IL-28A 处理的 HUVEC 中的血管生成反应和 eNOS/AKT 信号传导。IL-28A 诱导的微血管发芽形成在 HSP70-1 缺陷和 HSP70-1 转基因小鼠中得到证实。IL-28A 注射加速了后肢缺血小鼠的血流恢复。最后,IL-10Rβ 基因的消融阻碍了 HUVECs 中 IL-28A 刺激的血管生成反应和 eNOS/AKT 信号传导。
HSP70-1 通过 eNOS/AKT 信号传导和 AP-1/NF-κB/MMP-2 网络驱动 IL-28A/IL-10Rβ 轴的血管生成进展。
更新日期:2024-08-09
Journal of Advanced Research ( IF 11.4 ) Pub Date : 2024-08-09 , DOI: 10.1016/j.jare.2024.08.013 Jun-Hui Song 1 , Byungdoo Hwang 1 , Sung Lyea Park 1 , Hoon Kim 1 , Soontag Jung 1 , Changsun Choi 1 , Hwan Myung Lee 2 , Seok-Joong Yun 3 , Yung Hyun Choi 4 , Eun-Jong Cha 5 , Cam Patterson 6 , Wun-Jae Kim 7 , Sung-Kwon Moon 1
Affiliation
|
Introduction
Angiogenesis plays a significant role in the development of tumor progression and inflammatory diseases. The role of IL-28A in angiogenesis and its precise regulatory mechanisms remain rarely elucidated.Objectives
We report the novel regulatory role of IL-28A in physiological angiogenesis. The study aimed to elucidate the regulatory mechanisms involved in IL-28A-mediated angiogenesis and identify key genes associated with IL-28A-induced angiogenic responses.Methods
To know the effect of IL-28A on angiogenesis, HUVECs were applied to perform proliferation, migration, invasion, tube formation, immunoblot, and EMSA. Gene expression changes in HUVECs following IL-28A treatment were analyzed by NGS. The functional role of HSP70-1 and IL-10Rβ in IL-28A-induced angiogenic responses was evaluated using PCR and siRNA knockdown. Animal studies were conducted by aortic ring ex vivo assays, Matrigel plug in vivo assays, and immunochemistry using HSP70-1 knockout and transgenic mice models. The efficacy of IL-28A in angiogenesis was confirmed in a hind-limb ischemia model.Results
Autocrine/paracrine actions in HUVECs regulated IL-28A protein expression. Exogenous IL-28A increased the proliferation of HUVECs via eNOS/AKT and ERK1/2 signaling. IL-28A treatment promoted migration, invasion, and capillary tube formation of HUVECs through induction of the AP-1/NF-κB/MMP-2 network, which was associated with eNOS/AKT and ERK1/2 signaling. The efficacy of IL-28A-induced angiogenic potential was confirmed by aortic ring and Matrigel plug assay. HSP70-1 was identified as an IL-28A-mediated angiogenic effector gene using bioinformatics. Knockdown of HSP70-1 abolished angiogenic responses and eNOS/AKT signaling in IL-28A-treated HUVECs. IL-28A-induced microvessel sprouting formation was testified in HSP70-1-deficient and HSP70-1 transgenic mice. Flow recovery in hind-limb ischemia mice was accelerated by IL-28A injection. Finally, ablation of the IL-10Rβ gene impeded the angiogenic responses and eNOS/AKT signaling stimulated by IL-28A in HUVECs.Conclusion
HSP70-1 drives the progression of angiogenesis by the IL-28A/IL-10Rβ axis via eNOS/AKT signaling and the AP-1/NF-κB/MMP-2 network.中文翻译:

IL-28A/IL-10Rβ 轴通过调节 HSP70-1 表达,通过 eNOS/AKT 信号传导和 AP-1/NF-κB/MMP-2 网络促进血管生成
介绍
血管生成在肿瘤进展和炎症性疾病的发展中起着重要作用。IL-28A 在血管生成中的作用及其精确的调节机制仍然很少阐明。
目标
我们报道了 IL-28A 在生理性血管生成中的新调节作用。该研究旨在阐明 IL-28A 介导的血管生成所涉及的调控机制,并确定与 IL-28A 诱导的血管生成反应相关的关键基因。
方法
为了了解 IL-28A 对血管生成的影响,应用 HUVEC 进行增殖、迁移、侵袭、管形成、免疫印迹和 EMSA。通过 NGS 分析 IL-28A 处理后 HUVECs 的基因表达变化。使用 PCR 和 siRNA 敲低评估 HSP70-1 和 IL-10Rβ 在 IL-28A 诱导的血管生成反应中的功能作用。使用 HSP70-1 敲除和转基因小鼠模型,通过主动脉环离体试验、Matrigel 插入体内试验和免疫化学进行动物研究。IL-28A 在后肢缺血模型中证实了 IL-28A 在血管生成中的疗效。
结果
HUVECs 中的自分泌/旁分泌作用调节 IL-28A 蛋白表达。外源性 IL-28A 通过 eNOS/AKT 和 ERK1/2 信号传导增加 HUVECs 的增殖。IL-28A 治疗通过诱导 AP-1/NF-κB/MMP-2 网络促进 HUVECs 的迁移、侵袭和毛细管形成,这与 eNOS/AKT 和 ERK1/2 信号传导相关。IL-28A 诱导的血管生成电位的疗效通过主动脉环和基质胶栓试验得到证实。使用生物信息学将 HSP70-1 鉴定为 IL-28A 介导的血管生成效应基因。敲除 HSP70-1 消除了 IL-28A 处理的 HUVEC 中的血管生成反应和 eNOS/AKT 信号传导。IL-28A 诱导的微血管发芽形成在 HSP70-1 缺陷和 HSP70-1 转基因小鼠中得到证实。IL-28A 注射加速了后肢缺血小鼠的血流恢复。最后,IL-10Rβ 基因的消融阻碍了 HUVECs 中 IL-28A 刺激的血管生成反应和 eNOS/AKT 信号传导。
结论
HSP70-1 通过 eNOS/AKT 信号传导和 AP-1/NF-κB/MMP-2 网络驱动 IL-28A/IL-10Rβ 轴的血管生成进展。































 京公网安备 11010802027423号
京公网安备 11010802027423号