当前位置:
X-MOL 学术
›
Gastroenterology
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Organoids for Functional Precision Medicine in Advanced Pancreatic Cancer
Gastroenterology ( IF 25.7 ) Pub Date : 2024-06-10 , DOI: 10.1053/j.gastro.2024.05.032
Alice Boilève 1 , Jérôme Cartry 2 , Negaar Goudarzi 3 , Sabrina Bedja 2 , Jacques R R Mathieu 2 , Mohamed-Amine Bani 4 , Rémy Nicolle 5 , Ali Mouawia 6 , Ryme Bouyakoub 7 , Claudio Nicotra 8 , Maud Ngo-Camus 8 , Bastien Job 9 , Karélia Lipson 7 , Valérie Boige 10 , Marine Valéry 10 , Anthony Tarabay 10 , Peggy Dartigues 4 , Lambros Tselikas 11 , Thierry de Baere 11 , Antoine Italiano 8 , Simona Cosconea 12 , Maximiliano Gelli 13 , Elena Fernandez-de-Sevilla 13 , Maxime Annereau 14 , David Malka 15 , Cristina Smolenschi 16 , Michel Ducreux 1 , Antoine Hollebecque 16 , Fanny Jaulin 17
中文翻译:

用于晚期胰腺癌功能精准医学的类器官
患者来源的类器官 (PDO) 是有前途的肿瘤化身,可以使离体药物测试在功能精准肿瘤学的框架内对患者的治疗进行个性化。然而,临床证据仍然很少。本研究旨在评估 PDO 是否可以在临床实践中实施以使晚期难治性胰腺导管腺癌 (PDAC) 患者受益。
在 2021 年至 2022 年期间,87 名患者被前瞻性纳入机构审查委员会批准的方案。纳入标准是经组织学证实的 PDAC,肿瘤部位可及。对一组 25 种批准的抗肿瘤疗法 (chemogram) 进行了测试,并与患者反应进行了比较,以评估 PDO 预测值并绘制 PDAC 中的药物敏感性景观。
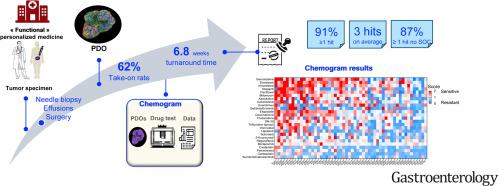
从 87 名接受治疗的患者中生成了 54 个 PDO (接受率,62%)。主要 PDO 突变为 KRAS (96%) 、 TP53 (88%) 和 CDKN2A/B (22%),与其起源肿瘤的一致性为 91%。化疗图的平均周转时间为 6.8 周。在 91% 的病例中,确定了 ≥1 次命中(吉西他滨(54 次中的 n = 20 次)、多西他赛(54 次中的 n = 18 次)和长春瑞滨(54 次中的 n = 17 次),中位数为 3 次命中/患者(范围,0-12)。我们的队列包括 34 名可评估的患者,并进行了全面的临床随访。我们报告的化疗图敏感性为 83.3%,特异性为 92.9%。与接受非 hit 药物 (作为常规管理的一部分) 的患者相比,接受 HIT 治疗的患者的总体缓解率和无进展生存期更高。最后,我们利用我们的 PDO 集合作为药物验证和组合鉴定的平台。我们测试了单独或联合使用抗 KRASG12D (MRTX1133),并确定了与 KRASG12D 变体中抗 EGFR 疗法的特定协同作用。
我们报告了旨在实施基于 PDO 的功能精准肿瘤学的最大前瞻性研究,并在这种临床环境中确定了非常稳健的预测价值。在临床相关的周转时间内,我们确定了 91% 患者的推定命中率,为这种非常积极的适应症提供了意想不到的潜在生存益处。尽管这在介入性精准肿瘤学试验中仍有待证实,但 PDO 收集已经为药物和组合治疗开发提供了强大的机会。
更新日期:2024-06-10
Gastroenterology ( IF 25.7 ) Pub Date : 2024-06-10 , DOI: 10.1053/j.gastro.2024.05.032
Alice Boilève 1 , Jérôme Cartry 2 , Negaar Goudarzi 3 , Sabrina Bedja 2 , Jacques R R Mathieu 2 , Mohamed-Amine Bani 4 , Rémy Nicolle 5 , Ali Mouawia 6 , Ryme Bouyakoub 7 , Claudio Nicotra 8 , Maud Ngo-Camus 8 , Bastien Job 9 , Karélia Lipson 7 , Valérie Boige 10 , Marine Valéry 10 , Anthony Tarabay 10 , Peggy Dartigues 4 , Lambros Tselikas 11 , Thierry de Baere 11 , Antoine Italiano 8 , Simona Cosconea 12 , Maximiliano Gelli 13 , Elena Fernandez-de-Sevilla 13 , Maxime Annereau 14 , David Malka 15 , Cristina Smolenschi 16 , Michel Ducreux 1 , Antoine Hollebecque 16 , Fanny Jaulin 17
Affiliation
|
Background & Aims
Patient-derived organoids (PDOs) are promising tumor avatars that could enable ex vivo drug tests to personalize patients’ treatments in the frame of functional precision oncology. However, clinical evidence remains scarce. This study aims to evaluate whether PDOs can be implemented in clinical practice to benefit patients with advanced refractory pancreatic ductal adenocarcinoma (PDAC).Methods
During 2021 to 2022, 87 patients were prospectively enrolled in an institutional review board–approved protocol. Inclusion criteria were histologically confirmed PDAC with the tumor site accessible. A panel of 25 approved antitumor therapies (chemogram) was tested and compared to patient responses to assess PDO predictive values and map the drug sensitivity landscape in PDAC.Results
Fifty-four PDOs were generated from 87 pretreated patients (take-on rate, 62%). The main PDO mutations were KRAS (96%), TP53 (88%), and CDKN2A/B (22%), with a 91% concordance rate with their tumor of origin. The mean turnaround time to chemogram was 6.8 weeks. In 91% of cases, ≥1 hit was identified (gemcitabine (n = 20 of 54), docetaxel (n = 18 of 54), and vinorelbine (n = 17 of 54), with a median of 3 hits/patient (range, 0–12). Our cohort included 34 evaluable patients with full clinical follow-up. We report a chemogram sensitivity of 83.3% and specificity of 92.9%. The overall response rate and progression-free survival were higher when patients received a hit treatment as compared to patients who received a nonhit drug (as part of routine management). Finally, we leveraged our PDO collection as a platform for drug validation and combo identification. We tested anti-KRASG12D (MRTX1133), alone or combined, and identified a specific synergy with anti-EGFR therapies in KRASG12D variants.Conclusions
We report the largest prospective study aiming at implementing PDO-based functional precision oncology and identify very robust predictive values in this clinical setting. In a clinically relevant turnaround time, we identify putative hits for 91% of patients, providing unexpected potential survival benefits in this very aggressive indication. Although this remains to be confirmed in interventional precision oncology trials, PDO collection already provides powerful opportunities for drugs and combinatorial treatment development.中文翻译:

用于晚期胰腺癌功能精准医学的类器官
背景和目标
患者来源的类器官 (PDO) 是有前途的肿瘤化身,可以使离体药物测试在功能精准肿瘤学的框架内对患者的治疗进行个性化。然而,临床证据仍然很少。本研究旨在评估 PDO 是否可以在临床实践中实施以使晚期难治性胰腺导管腺癌 (PDAC) 患者受益。
方法
在 2021 年至 2022 年期间,87 名患者被前瞻性纳入机构审查委员会批准的方案。纳入标准是经组织学证实的 PDAC,肿瘤部位可及。对一组 25 种批准的抗肿瘤疗法 (chemogram) 进行了测试,并与患者反应进行了比较,以评估 PDO 预测值并绘制 PDAC 中的药物敏感性景观。
结果
从 87 名接受治疗的患者中生成了 54 个 PDO (接受率,62%)。主要 PDO 突变为 KRAS (96%) 、 TP53 (88%) 和 CDKN2A/B (22%),与其起源肿瘤的一致性为 91%。化疗图的平均周转时间为 6.8 周。在 91% 的病例中,确定了 ≥1 次命中(吉西他滨(54 次中的 n = 20 次)、多西他赛(54 次中的 n = 18 次)和长春瑞滨(54 次中的 n = 17 次),中位数为 3 次命中/患者(范围,0-12)。我们的队列包括 34 名可评估的患者,并进行了全面的临床随访。我们报告的化疗图敏感性为 83.3%,特异性为 92.9%。与接受非 hit 药物 (作为常规管理的一部分) 的患者相比,接受 HIT 治疗的患者的总体缓解率和无进展生存期更高。最后,我们利用我们的 PDO 集合作为药物验证和组合鉴定的平台。我们测试了单独或联合使用抗 KRASG12D (MRTX1133),并确定了与 KRASG12D 变体中抗 EGFR 疗法的特定协同作用。
结论
我们报告了旨在实施基于 PDO 的功能精准肿瘤学的最大前瞻性研究,并在这种临床环境中确定了非常稳健的预测价值。在临床相关的周转时间内,我们确定了 91% 患者的推定命中率,为这种非常积极的适应症提供了意想不到的潜在生存益处。尽管这在介入性精准肿瘤学试验中仍有待证实,但 PDO 收集已经为药物和组合治疗开发提供了强大的机会。

































 京公网安备 11010802027423号
京公网安备 11010802027423号