Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
结合蛋白质相分离和生物正交连接以共固定酶以进行级联生物催化
Small ( IF 13.0 ) Pub Date : 2024-08-12 , DOI: 10.1002/smll.202404018
Shujiao Wu 1 , Lingling Luo 1 , Houtian Luo 1 , Li Qiao 2 , Haomin Chen 2 , Mijun Li 1 , Xiaolin Pei 2 , Tian Xie 1 , Anming Wang 2 , Roger A Sheldon 3, 4
Affiliation
|
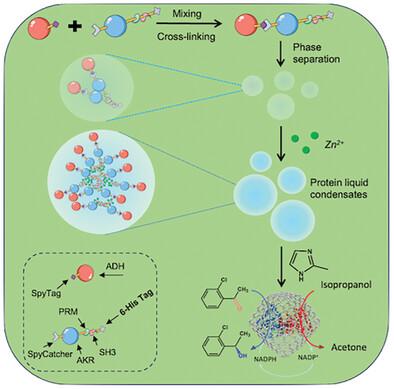
用于载体生物催化的多种酶的设计和有序共固定化具有挑战性。在这里,蛋白质相分离和生物正交连接的组合用于生成含有共固定化酶的沸石咪唑框架 (ZIF-8)。Zn2+ 离子诱导最小蛋白质模块的聚集,例如 6-His 标签、富含脯氨酸的基序 (PRM) 和 SRC 同源 3 (SH3) 结构域,并允许偶联的醛酮还原酶 (AKR) 和醇脱氢酶 (ADH) 在低浓度下进行相分离。这是通过将 SpyCatcher 和 PRM-SH3-6His 肽片段分别融合到 AKR 的 C 端和 N 末端,以及将 SpyTag 融合到 ADH 来实现的。添加 2-甲基咪唑导致液滴形成,并能够原位空间包埋重组 AKR 和 ADH,以产生封装在 ZIF-8 (AAE@ZIF) 中的级联生物解析系统。在合成 (S)-1-(2-氯苯基)乙醇时,经过 6 次循环,收率仍可达 91%,每个循环的对映体过量 (ee) 值为 99.99%。然而,当使用传统封装的 AKR 和 ADH 在 ZIF-8 中时,产率只能达到 72.9%。因此,这项工作表明,蛋白质相分离和生物正交连接的结合能够在 ZIF-8 中原位创建稳定且空间组织良好的双酶系统,并增强通道效应。

"点击查看英文标题和摘要"

































 京公网安备 11010802027423号
京公网安备 11010802027423号